
| A. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| B. | 碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强 | |
| C. | 随核电荷数的增加,碱金属的熔沸点逐渐降低 | |
| D. | 溴单质与水的反应比氟单质与水的反应更剧烈 |
分析 依据同主族元素,从上到下,原子半径依次增大,金属性依次增强,非金属性依次减弱解答.
解答 解:A.同主族元素,从上到下,原子半径依次增大,故A正确;
B.同主族元素,从上到下,金属性依次增强,则锂原子失去最外层电子的能力最弱,非金属性依次减弱,则卤素中氟原子得电子的能力最强,故B正确;
C.随核电荷数的增加,原子半径减小,金属键减弱,则碱金属的熔沸点逐渐降低,故C正确;
D.同主族元素,从上到下,非金属性依次减弱,氟排在溴的上边,非金属性强于溴,所以与水反应比溴与水反应剧烈,故D错误;
故选:D.
点评 本题考查了碱金属、卤族元素性质,题目难度不大,掌握同主族元素性质的递变规律是解题的关键.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | A单质能与B的氢化物水溶液反应,生成B单质 | |
| B. | A元素的最高正价比B元素的最高正价要高 | |
| C. | 气态氢化物溶于水后的酸性:A比B更强 | |
| D. | A原子得到电子的数目比B原子少 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均能与盐酸反应 |
| B | 向品红溶液中通入过量SO2 | 溶液褪色 | SO2有强氧化性 |
| C | 将分别蘸有浓氨水与浓盐酸的玻璃棒靠近 | 有白雾出现 | 氨气与氯化氢反应生成氯化铵 |
| D | 将新制氯水滴入石蕊试液中 | 溶液先变红后褪色 | HClO既有酸性又有强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2L氯气含有的分子数为0.5NA | |
| B. | 在常温常压下,1mol氦气含有的原子数为NA | |
| C. | 32g氧气含有的原子数目为NA | |
| D. | 标准状况下,1L乙烷完全燃烧后,所生成的气态产物的分子数为6NA/22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电极材料为铁和锌,电解质溶液为FeCl3溶液 | |
| B. | 电极材料为铁和铜,电解质溶液为Fe(NO3)3溶液 | |
| C. | 电极材料为铁和石墨,电解质溶液为FeCl2溶液 | |
| D. | 电极材料为石墨,电解质溶液为FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
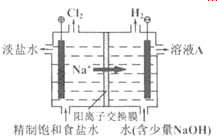 生产生活中广泛涉及氧化还原反应.
生产生活中广泛涉及氧化还原反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com