
| A. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、NO3- | |
| B. | 在某无色溶液中:MnO4-、K+、H+、IO3- | |
| C. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Na+、ClO-、NO3- | |
| D. | 水电离出 c(H+)=10-12 的溶液中:Mg2+、Cu2+、SO42-、K+ |
分析 A.铁离子与硫氰根离子发生双水解反应;
B.高锰酸根离子为有色离子;
C.该溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
D.钙溶液中存在大量氢离子或氢氧根离子,镁离子、铜离子与氢氧根离子反应.
解答 解:A.Fe3+、ClO-之间发生双水解反应,在溶液中不能大量共存,故A错误;
B.MnO4-为有色离子,在溶液中不能大量共存,故B错误;
C.在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中存在氢氧根离子,K+、Na+、ClO-、NO3-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故C正确;
D.水电离出 c(H+)=10-12 的溶液中存在大量氢离子或氢氧根离子,Mg2+、Cu2+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 在CH2=CH2分子中,存在4个σ键和一个π键 | |
| B. | 在共价化合物中,一定存在极性键,可能存在非极性键,一定不存在离子键 | |
| C. | N、O、F电负性大小:F>O>N;第一电离能大小:F>O>N | |
| D. | 酸性强弱:H2SO4>H2SO3>H2SeO3;岩浆晶出的先后顺序:SiO2、MgSiO3、CaSiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是
乙酸橙花酯兼有橙花和玫瑰花香气,其结构简式如图.关于该有机物的叙述中正确的是| A. | ②④⑤ | B. | ①④⑤ | C. | ②③⑤ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 0.1 mol丙烯酸(CH2=CHCOOH)中含有碳原子的数目为0.2NA | |
| C. | 标准状况下,11.2LCCl4中含有分子的数目为0.5NA | |
| D. | 在2Na2O2+2H2O═4NaOH+O2↑的反应中,每生成0.1 mol氧气,转移电子的数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
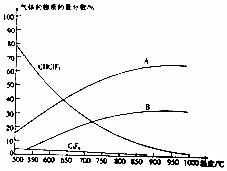 氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛.
氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和反应未完成前随着NaOH溶液的滴加,-OOCCH2COO-的物质的量浓度逐渐升高 | |
| B. | 若滴入的NaOH溶液的体积=10mL时溶液温度最高,则丙二酸的物质的量浓度=0.1mol•L-1 | |
| C. | 在丙二酸未完全中和前,随着NaOH的滴加,水的电离程度逐渐增大 | |
| D. | 若忽略丙二酸氢根离子的电离和水解,丙二酸根离子的水解常数约为7.14×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 小苏打用作焙制糕点的膨松剂 | Na2CO3溶液呈碱性 |
| B | 明矾可用于净水 | 明矾在水中生成的氢氧化铝胶体有吸附性 |
| C | SiO2用于制造光导纤维 | SiO2有导电性 |
| D | SO2可使溴水褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7 | |
| B. | 钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 | |
| C. | 高氯酸的酸性与氧化性均大于次氯酸的酸性和氧化性 | |
| D. | 邻羟基苯甲醛的熔点低于对羟基苯甲醛的熔点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10.0g D2O和H218O的混合物所含质子总数为5 NA | |
| B. | 标准状况下,22.4 L己烷含有的共价键数目为19 NA | |
| C. | 1.01、0.1 mol.L-1 NaAlO2溶液中含有的氧原子数目为0.2NA | |
| D. | 1mol Na2O和BaO2的混合物中含有的阴、阳离子总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com