
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3·H2O) > c(NH4+)> c(Cl-)> c(OH-)
C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
D.0.1 mol/LNa2CO3与0.1mol/L NaHCO3溶液等体积混合:![]() c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
【答案】AD
【解析】
试题分析:A.NaHSO4溶液中存在质子守恒分析,硫酸氢钠电离出钠离子、氢离子、硫酸根离子,NaHSO4 =Na++H++SO42-,H2O![]() H++OH-,溶液中质子守恒,c(H+)=c(SO42-)+c(OH-),故A正确;B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7),说明溶液中一水合氨电离大于铵根离子水解溶液呈碱性,c(NH4+)>c(Cl-)>c(NH3H2O)>c(OH-),故B错误;C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸)反应生成氯化钠、NaHC2O4,溶液中存在电荷守恒为:c(Cl-)+2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+),故C错误;D.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:n(Na):n(C)=3:2,溶液中物料守恒得到:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故D正确;故选AD。
H++OH-,溶液中质子守恒,c(H+)=c(SO42-)+c(OH-),故A正确;B.0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7),说明溶液中一水合氨电离大于铵根离子水解溶液呈碱性,c(NH4+)>c(Cl-)>c(NH3H2O)>c(OH-),故B错误;C.0.1mol/LNa2C2O4与0.1mol/LHCl溶液等体积混合(H2C2O4为二元弱酸)反应生成氯化钠、NaHC2O4,溶液中存在电荷守恒为:c(Cl-)+2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+),故C错误;D.0.1mol/LNa2CO3与0.1mol/LNaHCO3溶液等体积混合:n(Na):n(C)=3:2,溶液中物料守恒得到:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故D正确;故选AD。


科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)一般情况下,当温度升高时,电离平衡常数K________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力最强的是______(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a.CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+2HClO=CO2↑+H2O+2ClO- d.2ClO-+CO2+H2O=CO32-+2HClO
(4)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
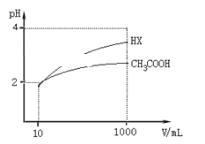
则HX的电离平衡常数________(填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理解释的是
①由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
②用排饱和食盐水法收集Cl2
③高压比常压 有利于提高合成氨的产率
④高温下合成氨速率较快
⑤工业制取金属钾Na(l)+ KCl(l) ![]() NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选适宜的温度,使K成蒸气从反应混合物中分离出来
A. ②③⑤ B. ①②③⑤ C. ①②③④⑤ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2溶于水后,与水反应生成H2SO3,下列对于H2SO3的性质预测正确的是( )
A.有氧化性,无还原性,无酸性
B.有氧化性,有还原性,有酸性
C.有还原性,无氧化性,无酸性
D.有还原性,无氧化性,有酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)![]() 2B(g)+C (g),下列能说明反应已达平衡状态的是
2B(g)+C (g),下列能说明反应已达平衡状态的是
A. 混合气体的密度保持不变 B. 容器内B、C的浓度之比为2∶1
C. B的生成速率等于C的消耗速率 D. 气体的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.01 mol/L 的H2O2、H2SO4、KI、Na2S2O3溶液及淀粉混合,一定时间后溶液变为蓝色。该实验是一种“碘钟实验”。某小组同学在室温下对该“碘钟实验”的原理进行探究。
(资料)
该“碘钟实验”的总反应:H2O2 +2S2O32-+2H+=S4O62-+2H2O
反应分两步进行:
反应A:H2O2+2I-+2H+=I2+2H2O
反应B:……
(1)反应B的离子方程式是______。对于总反应,I-的作用相当于______。
(2)为证明反应A、B的存在,进行实验Ⅰ。
a.向酸化的H2O2溶液中加入试剂X的水溶液,溶液变为蓝色。
b.再向得到的蓝色溶液中加入Na2S2O3溶液,溶液的蓝色褪去。
试剂X是______。
(3)为探究溶液变蓝快慢的影响因素,进行实验Ⅱ、实验Ⅲ。(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液 (含淀粉) | H2O |
实验Ⅱ | 5 | 4 | 8 | 3 | 0 |
实验Ⅲ | 5 | 2 | x | y | z |
溶液从混合时的无色变为蓝色的时间:实验Ⅱ是30 min、实验Ⅲ是40 min。
①实验Ⅲ中,x、y、z所对应的数值分别是______。
②对比实验Ⅱ、实验Ⅲ,可得出的实验结论是______。
(4)为探究其他因素对该“碘钟实验”的影响,进行实验Ⅳ。
(溶液浓度均为0.01 mol/L)
试剂 序号 用量(mL) | H2O2 溶液 | H2SO4 溶液 | Na2S2O3 溶液 | KI溶液(含淀粉) | H2O |
实验Ⅳ | 4 | 4 | 9 | 3 | 0 |
实验过程中,溶液始终无明显颜色变化。
试结合该“碘钟实验”总反应方程式及反应A与反应B速率的相对快慢关系,解释实验Ⅳ未产生颜色变化的原因:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化锶(SrO2·2H2O)晶体是一种白色粉末,微溶于水,常用作焰火的引火剂。制备流程如下:
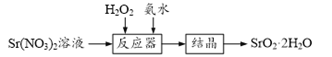
反应原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3,该反应放热。
(1)选择不同浓度的双氧水在反应器中反应,测得相同时间H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比20%的H2O2的利用率低的原因是______。

(2)SrO2·2H2O与CO2会反应变质,反应的化学方程式为______。
(3)25℃时,将Sr(NO3)2溶液滴加到含有F-、CO32-的溶液中,当c(Sr2+)=0.0010 mol·L-1时,同时存在SrF2、SrCO3两种沉淀,则此时溶液中c(F-):c(CO32-)=______。[已知25℃时:Ksp(SrF2)=4.0×10-9,Ksp(SrCO3)=5.0×10-9]
(4)准确称取1.8000 g SrO2·2H2O样品置于锥形瓶中,加入适量的盐酸使之充分转化为H2O2,再加入足量KI,摇匀后置于暗处,充分反应后,加入少量淀粉试液,用1.0000 mol·L-1 Na2S2O3标准液滴定到蓝色恰好消失时,共消耗标准液20.00 mL,计算SrO2·2H2O样品的纯度,写出计算过程________。(已知:S2O32-![]() S4O62-)
S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某恒容密闭容器中充入等物质的量的A 和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:
2C(g),达到平衡后,在不同的时间段,分别改变影响反应的一个条件,测得容器中物质的物质的量浓度、反应速率分别随时间的变化如图所示:

下列说法中正确的是
A. 30 min~40 min 之间该反应使用了催化剂
B. 反应方程式中的x=2,正反应为吸热反应
C. 30 min 时条件的变化是降低压强,40 min 时条件的变化是升高温度
D. 前20 min A 的平均反应速率为0.08 molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CH3![]() COOH被还原剂直接还原生成两种乳酸(CH3
COOH被还原剂直接还原生成两种乳酸(CH3![]() COOH)。如果将CH3
COOH)。如果将CH3![]() COOH与薄荷醇(C10H19OH)酯化后,再通过还原反应、水解反应,则得到的主要产物是一种乳酸,实现了不对称合成。其过程如下:
COOH与薄荷醇(C10H19OH)酯化后,再通过还原反应、水解反应,则得到的主要产物是一种乳酸,实现了不对称合成。其过程如下:
CH3COCOOH![]() A
A![]() B
B![]() CH3
CH3![]() COOH
COOH
(1)CH3![]() COOH中________(填“有”或“无”)手性碳原子。CH3
COOH中________(填“有”或“无”)手性碳原子。CH3![]() COOH中___________(填“有”或“无”)手性碳原子,两种乳酸的关系为______________。
COOH中___________(填“有”或“无”)手性碳原子,两种乳酸的关系为______________。
(2)A的分子式为____________,B的分子式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com