
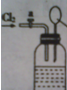
 向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:
向如图所示连有一甲烷气球并盛有一定量饱和硝酸银溶液的实验装置通入足量氯气,假设氯气在饱和硝酸银溶液中不溶解:| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 光照 |
| 光照 |


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
| A、①②③ | B、②③④ |
| C、①④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
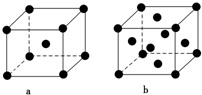 已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E.又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的.D原子得到一个电子后其3p轨道将全充满.B+离子比D原子形成的离子少一个电子层.C与B可形成BC型的离子化合物.E的原子序数为29.| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ?mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.335 |
| 1:3 | 0.75 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com