
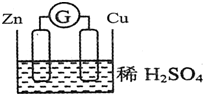
 请观察如图装置,回答下列问题:
请观察如图装置,回答下列问题:分析 该装置为原电池,将化学能转变为电能,Zn易失电子发生氧化反应作负极、Cu得电子发生还原反应作正极,负极上电极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,根据两极得失电子总数相等进行计算.
解答 解:①该装置为原电池,将化学能转变为电能,Zn易失电子发生氧化反应作负极、Cu得电子发生还原反应作正极,负极上电极反应式为Zn-2e-=Zn2+、正极反应式为2H++2e-=H2↑,故答案为:Zn;氧化;
②正极上氢离子得电子生成氢气,反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
③该装置为原电池,将化学能转变为电能,负极上锌失去电子发生氧化反应,电极反应式为Zn-2e-=Zn2+,当导线中有0.2mol e-发生转移时,参加氧化反应的锌的物质的量为0.1mol,故答案为:化学能转变为电能; 0.1mol.
点评 本题考查了原电池原理,明确正负极上发生的反应即可解答,根据电极反应式进行计算,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示 | |
| B. | 化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态 | |
| C. | 决定化学反应速率的主要因素是温度 | |
| D. | 催化剂只能加快化学反应速率,不能提高原料利用率和转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 二氧化碳电子式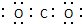 | |
| D. | 第三周期元素形成的简单离子中,半径最小的是Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Bi3Ge3O15 | B. | Bi4Ge3O12 | C. | Bi4Ge3O16 | D. | Bi3Ge3O12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2 | |
| B. | 医学上常用新制的Cu(OH)2悬浊液检验尿液中的葡萄糖 | |
| C. | 工业上利用油脂在酸的催化作用下发生水解来生产肥皂 | |
| D. | 向蛋白质溶液中加入浓的Na2SO4或CuSO4溶液均可使蛋白质盐析而分离提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
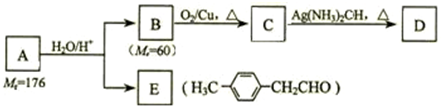
 .
. 、
、 、
、 (其中一种).
(其中一种).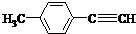 )的一条路线如下:
)的一条路线如下: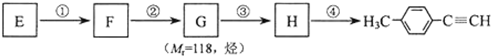
 ;
;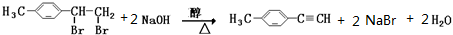 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
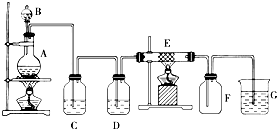
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2SiO3溶液中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| B. | 常温下,铁和稀硝酸反应:2Fe+6HNO3═2Fe(NO3)3+3H2↑ | |
| C. | 碳酸氢钠和过量稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铜和浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑤ | C. | ②⑤ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com