
25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) △H2=-511kJ·mol-1
下列说法正确的是( )
A.①和②产物的阴阳离子个数比不相等
B.①和②生成等物质的量的产物,转移电子数不同
C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D.25℃、101kPa下,Na2O2(s)+2Na(s)=2Na2O(s) △H=-317kJ·mol-1
D
【解析】
试题分析:A、在Na2O中阳离子是钠离子、阴离子是氧离子,Na2O2中阳离子是钠离子、阴离子是过氧根离子,因此阴、阳离子的个数比都是1:2,①和②产物的阴阳离子个数比相等,故A错误;B、由钠原子守恒可知,①和②生成等物质的量的产物时,钠元素的化合价都是由0升高到+1价,则转移的电子数相同,故B错误;C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O2,且速率逐渐加快,故C错误;D、热化学方程式25℃、101kPa下:①2Na(s)+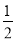 O2(g)═Na2O(s)△H=-414kJ?mol-1,②2Na(s)+O2(g)═Na2O2(s)△H=-511kJ?mol-1,①×2-②可得:Na2O2(s)+2Na(s)═2Na2O(s)△H=-317kJ?mol-1,故D正确,故选:D。
O2(g)═Na2O(s)△H=-414kJ?mol-1,②2Na(s)+O2(g)═Na2O2(s)△H=-511kJ?mol-1,①×2-②可得:Na2O2(s)+2Na(s)═2Na2O(s)△H=-317kJ?mol-1,故D正确,故选:D。
考点:考查化学键类型、氧化还原反应的计算、元素化合物知识、以及盖斯定律


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
已知25﹪的氨水密度为0.91g·cm-3,5﹪的氨水密度为0.98g·cm-3.若将上述两溶液等体积混合,所得氨水溶液的质量分数是( )
A.等于15﹪ B.大于15﹪ C.小于15﹪ D.无法估算
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32?、SO42?、NO3?中的几种。①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如下图所示。则下列说法正确的是( )
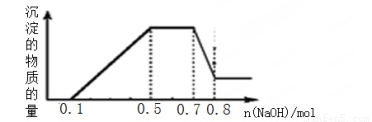
A.溶液中一定不含CO32?,可能含有SO42?和NO3?
B.在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3+ +4OH- =[Al(OH)4]-
C.溶液中的阳离子只有H+、Mg2+、Al3+
D.n(H+)∶n(NH4+)∶n(Mg2+) =2∶4∶1
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:填空题
(6分)1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是( )
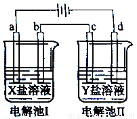
选项 | X | Y |
A. | AgNO3 | Cu(NO3)2 |
B. | MgSO4 | CuSO4 |
C. | FeSO4 | Al2 (SO4)3 |
D. | CuSO4 | AgNO3 |
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
几种短周期元素的原子半径和主要化合价见下表,下列说法中正确的是( )。
元素代号 | 原子半径/nm | 主要化合价 |
X | 0.160 | +2 |
Y | 0.143 | +3 |
Z | 0.102 | +6、-2 |
L | 0.099 | +7、-1 |
M | 0.077 | +4、-4 |
Q | 0.074 | -2 |
A.等物质的量的X、Y的单质与足量的盐酸反应,生成的H2一样多
B.Y与Q形成的化合物不能跟氢氧化钠溶液反应
C.Z的氢化物的稳定性强于L的氢化物的稳定性
D.在化学反应中,M原子与其他原子易形成共价键而不易形成离子键
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三终极预测理综化学试卷(解析版) 题型:推断题
【化学——选修5:有机化学基础】(15分)
化合物H可用以下路线合成:
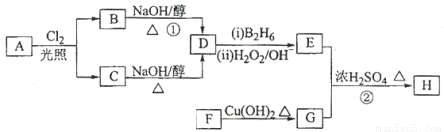
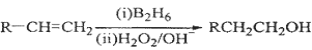
已知:
请回答下列问题:
(1)标准状况下11.2 L烃A在氧气中充分燃烧可以生成88 g CO2和45 g H2O,且A分子结构中有3个甲基,则A的结构简式为 ;
(2)B和C均为一氯代烃,D的名称(系统命名)为 ;
(3)在催化剂存在下1 mol F与2 mol H2反应,生成3—苯基—1—丙醇。F的结构简式是 ;
(4)反应①的反应类型是 ;
(5)反应②的化学方程式为 ;
(6)写出所有与G具有相同官能团的芳香类同分异构体的结构简式
。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
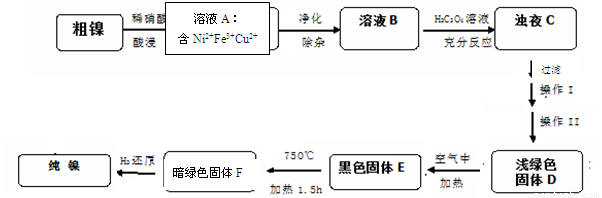
(14分)镍是一种十分重要的有色金属,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用。现对粗镍进行提纯,具体的反应流程如下:
已知:
①2Ni2O3 (黑色)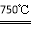 4NiO(暗绿色) + O2↑
4NiO(暗绿色) + O2↑
②
物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
Ksp | 8.8×10-36 | 2.2×10-20 | 5.48×10-16 | 3.2×10-19 |
根据信息回答:
(1)28Ni在周期表中的第 周期;镍与稀硝酸反应的离子方程式为 。实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃ 时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为 ;
(2)在溶液A的净化除杂中,首先将溶液A煮沸,调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3。为了得到纯净的溶液B还需要加入以下物质 进行除杂(填正确答案标号)。
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O。则操作I、II名称是 、 ; D生成E的化学方程式为 。
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为 mol。
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量。已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀。从实验误差角度分析主要原因为: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高一下学期期末考试化学试卷(解析版) 题型:选择题
六苯乙烷为白色固体,其结构表示如图:

下列有关说法中正确的是( )
A.它是一种苯的同系物,易溶于有机溶剂 B.它的分子式为C38H30,只含有非极性键
C.它的一氯代物只有三种 D.在同一平面上的原子最多有14个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com