
| A. | 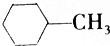 的一氯代物最多有4种 的一氯代物最多有4种 | |
| B. | 乙酸可与乙醇、金属钠、新制Cu(OH)2悬浊液等物质反应 | |
| C. | Cl2可与乙烷发生取代反应,与乙烯发生加成反应 | |
| D. | 阿托酸(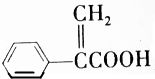 )可用于合成高分子材料 )可用于合成高分子材料 |
分析 A、有机物中有几种类型的氢原子就含有几种一氯代物;
B、乙酸和醇之间发生酯化反应、和金属钠反应生成氢气,和碱中和生成盐和水;
C、Cl2可与烷烃、芳香烃发生取代反应,与不饱和烃发生加成反应;
D、含有双键或是叁键的有机物可以发生加聚反应.
解答 解:A、有机物 中有5种类型的氢原子,就有5种一氯代物,故A错误;
中有5种类型的氢原子,就有5种一氯代物,故A错误;
B、乙酸和醇之间发生酯化反应、和金属钠反应生成氢气,和碱中和生成盐和水,乙酸可与乙醇、金属钠、新制Cu(OH)2悬浊液等物质反应,故B正确;
C、Cl2可与烷烃、芳香烃发生取代反应,与不饱和烃发生加成反应,可以得到:Cl2可与乙烷发生取代反应,与乙烯发生加成反应,故C正确;
D、含有双键或是叁键的有机物可以发生加聚反应,阿托酸( )可用于合成高分子材料,故D正确.
)可用于合成高分子材料,故D正确.
故选A.
点评 本题考查学生有机物的性质和应用知识,注意知识的归纳和梳理是关键,难度中等.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2.0 mol/L的醋酸溶液中氢离子为0.2 NA | |
| B. | 标准状况下,11.2L乙醇所含分子数为0.5NA | |
| C. | 71gCl2与足量的氢氧化钠反应,转移的电子数为2NA | |
| D. | 常温常压下,32gO2和O3的混合气体含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X气体的相对分子质量比Y气体的相对分子质量大 | |
| B. | X可能是C2H4,Y可能是CH4 | |
| C. | X气体的密度小于Y气体的密度 | |
| D. | 充气后A气球质量比B气球质量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
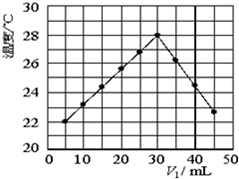 将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )
将V1mL1.0mol•L-1 H2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述不正确的是( )| A. | 做该实验时环境温度可能为20℃ | B. | 该实验表明化学能可以转化为热能 | ||
| C. | NaOH溶液的浓度约是1.5mol•L-1 | D. | 该实验表明中和反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的CaCl2和CaO2含有的离子数 | |
| B. | 等温等压下,质子数相等的CO、N2、C2H2三种气体含有的原子数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 物质的量相同的铁和铝分别与足量氯气完全反应时转移的电子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com