
用惰性电极以1A的电流电解0.5mol/L的KCl溶液200mL,当溶液的pH=12时,电解通电的时间是:
A、3分13秒 B、3分23秒 C、3分32秒 D、3分39秒
科目:高中化学 来源: 题型:阅读理解
 AgOH+H+
AgOH+H+ AgOH+H+
AgOH+H+
| ||
| ||

 门上的固体材料R可以采用
门上的固体材料R可以采用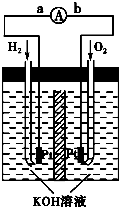 方向为
方向为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:高中化学习题1 题型:038
用惰性电极以1A的电流强度电解0.5mol/L的![]() 溶液200mL,当溶液的
溶液200mL,当溶液的![]() 时,停止电解.
时,停止电解.
求:(1)通电所需的时间.(2)生成![]() 的质量.
的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极以1A的电流电解200mL 0.5mol/L的KCl溶液。当溶液的pH==12时,电解通电的时间是 ( )
A.3min13s B.3.3min21s C.3min32s D.3min39s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com