
| A. | c(Na+)=2c(X2-) | B. | c(OH-)=c(H+)+2c(H2X)+c(HX-) | ||
| C. | c(X-)>c(Na+)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(OH-)+c(X2-)+c(HX-) |
分析 常温下,取0.1mol•L-1 H2X溶液与0.2mol•L-1 NaOH溶液等体积混合,反应后溶质为Na2X,测得混合溶液的pH=9,则H2X为弱酸,
A.根据Na2X溶液中的物料守恒判断;
B.根据Na2X中的质子守恒分析;
C.Na2X溶液中,c(Na+)>c(X-);
D.根据溶液中的电荷守恒判断.
解答 解:常温下,取0.1mol•L-1 H2X溶液与0.2mol•L-1 NaOH溶液等体积混合,反应后溶质为Na2X,测得混合溶液的pH=9,则H2X为弱酸,
A.混合液中一定满足物料守恒,根据物料守恒可得:c(Na+)═2c(X-)+2c(H2X)+2c(HX-),故A错误;
B.混合液中一定满足质子守恒,根据质子守恒恒可知:c(OH-)=c(H+)+2c(H2X)+c(HX-),故B正确;
C.溶液呈碱性,则c(OH-)>c(H+),Na2X溶液中c(Na+)>c(X-),溶液中离子浓度由大到小的顺序为:c(Na+)>c(X-)>c(OH-)>c(H+),故C错误;
D.溶液中一定满足电荷守恒,根据电荷守恒可得:(Na+)+c(H+)=c(OH-)+2c(X2-)+c(HX-),故D错误;
故选B.
点评 本题考查了酸碱混合溶液定性判断、溶液中离子浓度大小比较,题目难度中等,根据混合溶液酸碱性确定H2X的强弱为解答关键,注意掌握电荷守恒、物料守恒、质子守恒的含义及应用方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
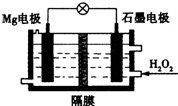 Mg-H2O2电池可用于驱动无人驾驶潜航器.该电池以海水为电解质溶液,示意如图.该电池工作时,下列不正确的是( )
Mg-H2O2电池可用于驱动无人驾驶潜航器.该电池以海水为电解质溶液,示意如图.该电池工作时,下列不正确的是( )| A. | Mg电极是该电池的负极 | B. | H2O2在石墨电极上发生还原反应 | ||
| C. | 石墨电极附近溶液的pH减小 | D. | 溶液中Cl-向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
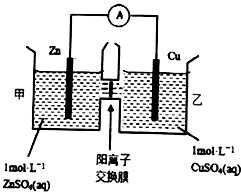
| A. | 铜电极上发生还原反应 | |
| B. | 电池工作一段时间后,甲池的c(SO42-)减小 | |
| C. | 电池工作一段时间后,乙池溶液的总质量不变 | |
| D. | 阳离子通过交换膜向正极移动,保持溶液中电荷平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ | |
| D. | 向次氯酸钠溶液中通入SO2:2ClO-+SO2+H2O═SO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与碳酸氢钠溶液 | B. | 澄清石灰水与碳酸氢铵溶液 | ||
| C. | 氢氧化钠溶液与碳酸氢钙溶液 | D. | 澄清石灰水与碳酸氢钙溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com