
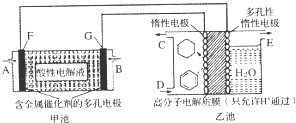
| A. | 甲池中A处通入H2,E处有O2放出 | B. | 甲池中H+由F极移向G极 | ||
| C. | 乙池中阴极区只有苯被还原 | D. | 导线中共传导11.2mol电子 |
分析 甲池装置是氢氧燃料电池,所以是原电池,原电池放电时,燃料失电子发生氧化反应,所以投放燃料的电极为负极,投放氧气的电极为正极,正极上氧气得电子发生还原反应,由于电解质溶液呈酸性,负极反应为:H2-2e-═2H+,正极反应为:O2+4e-+4H+═2H2O;该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-═2H2O+O2↑,所以G为负极,通入氢气,F为正极通入氧气,据此分析.
解答 解:A、阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,阳极上氢氧根离子放电生成氧气,电极反应式为:4OH--4e-═2H2O+O2↑,所以G为负极,即B通入氢气,E处产生氧气,故A错误;
B、甲池装置是氢氧燃料电池,H+由负极移向正极,即由G极移向F极,故B错误;
C、若参加反应的苯有10mol×24%-10mol×10%=1.4mol,乙池中阴极区苯放电的电极反应式为C6H6+6H++6e-=C6H12,1.4mol苯反应转移电子物质的量为1.4mol×6=8.4mol,所以乙池中阴极区不只有苯被还原,故C错误;
D、生成2.8mol氧气,据电极反应式4OH--4e-═2H2O+O2↑可知,转移电子物质的量为2.8mol×4=11.2mol,故D正确;
故选D.
点评 本题考查了氢氧燃料电池和电解池的相关知识,注意分析各电极反应,题目难度较大.


科目:高中化学 来源: 题型:选择题
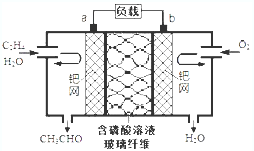 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,下列说法正确的是( )| A. | 每有0.1mol O2反应,则迁移H+0.4mol | |
| B. | 正极反应式为:CH2=CH2-2e-+2OH-=CH3CHO+H2O | |
| C. | 电子移动方向:电极a→磷酸溶液→电极b | |
| D. | 该电池为可充电电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厨房中用的食盐、食醋都是电解质 | |
| B. | 古代的陶瓷、砖瓦、现代的玻璃、水泥等,都是硅酸盐产品 | |
| C. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| D. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3、CH3CH2CH2CH2CH3、CH3CH2CH2CH2CH2CH3 | |
| B. | CH3CH=CHCHO、CH3CH=CHCH=CHCHO、CH3(CH=CH)3CHO | |
| C. | CH3CH2CH3、CH3CHClCH2CH3、CH3CHClCH2CHClCH3 | |
| D. | ClCH2CHClCCl3、ClCH2CHClCH2CHClCCl3、ClCH2CHClCH2CHClCH2CHClCCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①组物质都不能使酸性高锰酸钾褪色,②组物质都能使酸性高锰酸钾褪色 | |
| B. | ①组物质都不能使溴的四氯化碳褪色,②组物质都能使溴的四氯化碳褪色 | |
| C. | ②组物质所有原子可以在同一平面内 | |
| D. | 邻二甲苯的一氯代物只有两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Na+、I-、Fe3+ | B. | Mg2+、Cl-、NO3-、Al3+ | ||
| C. | K+、Cl-、HCO3-、SO42- | D. | Ba2+、Na+、Cl-、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
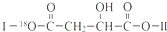 (其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.
(其中Ⅰ、Ⅱ为未知部分的结构).下列是X发生反应的转化关系图及E的信息.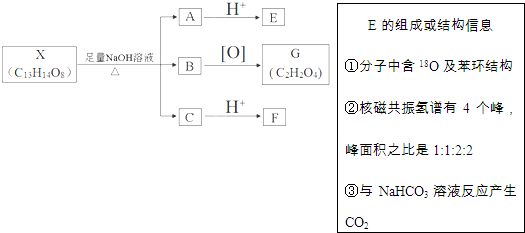
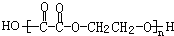 +(2n-1)H2O
+(2n-1)H2O +4NaOH$→_{△}^{水}$
+4NaOH$→_{△}^{水}$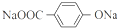 +NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O
+NaOOCCH2CH(OH)COOONa+HOCH2CH2OH+2H2O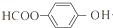 等
等查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持温度不变,缩小容器的体积,平衡向逆反应方向移动,再次达到平衡时气体的颜色变浅了 | |
| B. | 若保持恒温恒压,再充入一定量的NO2气体,当容器的体积不再变化时表明重新达到平衡状态 | |
| C. | 保持容器的体积不变,升高温度,正反应速率加快,逆反应速率减慢,平衡向正反应方向移动 | |
| D. | 恒温恒容条件下,再充入一定量的N2O4,达到新平衡时NO2的体积分数比原平衡的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com