
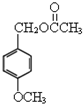
 乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图:
乙酸茴香酯具有花香和茴香香气,可作为配制食用香精的原料,其结构简式如图: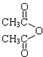 )反应制得.写出反应的化学方程式:
)反应制得.写出反应的化学方程式: )反应,生成乙酸茴香酯和乙酸;
)反应,生成乙酸茴香酯和乙酸; )反应,生成乙酸茴香酯和乙酸,反应为
)反应,生成乙酸茴香酯和乙酸,反应为 ,
, ;
;

科目:高中化学 来源: 题型:
| A、O3+2KI+H2O═2KOH+I2+O2 |
| B、2CH3COOH+Ca(CIO)2═2HClO+(CH3COO)2Ca |
| C、I2+2NaClO3═2NalO3+Cl2 |
| D、4HCl(浓)+MnO2═MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
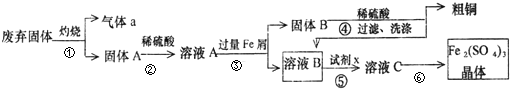
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 原因解释 |
| A | 将一片较簿的铝片放在酒精灯火焰上灼烧 | 铝片慢慢熔化呈液滴状 | 铝表面的氧化膜致密且熔点很高,阻碍铝与氧气的接触,同时铝的熔点较低熔化了 |
| B | 将等表面积的镁条、铝 片(均除去氧化膜)分 别放入装有等浓度、等 体积盐酸的两支试管中 | 都产生气泡,镁条表面产生气泡更快 | 镁的金属性比铝的金属性强,镁更易失去电子,所以反应更快 |
| C | 在打磨过的铁片上先滴 一滴饱和食盐水,再滴 一滴酚酞 | 液滴的外圈先出现红色 | 铁片不纯含有碳元素,铁、碳与食盐水形成原电池,溶液外圈发生吸氧腐蚀,导致c(OH-)增大,溶液呈碱性 |
| D | 取少量淀粉加稀硫酸, 加热几分钟,冷却后加 入新制氢氧化铜悬浊 液,加热至沸腾 | 未见砖红色沉淀生成 | 淀粉水解后没有葡萄糖生成 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、参加反应的硝酸是0.4mol |
| B、消耗氧气的体积为1.68 L |
| C、此反应过程中转移的电子为0.3 mol |
| D、混合气体中含NO21.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 浓度 | 28.42g/L | 1.6g/L |
| 排放标准 | pH 6~9 | 0.5mg/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
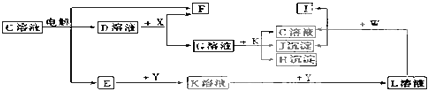
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入试剂(溶液) | 加入试剂后发生反应的离子方程式 |
| A | SO42-、Fe2+、NO3-、K+ | K3[Fe(CN)6] | 3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓ |
| B | Na+、Fe3+、I-、ClO- | H2SO4 | ClO-+H+=HClO |
| C | Ba2+、HCO3-、Cl-、H+ | Na2SO4 | Ba2++SO42-=BaSO4 |
| D | Al3+、Cl-、NO3-、K+ | 过量NaOH | Al3++3OH-=Al(OH)3↓ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com