
| A. | 次氯酸分子的结构式:H-Cl-O | B. | 硫离子的结构示意  | ||
| C. | 质量数为37的氯原子为:37Cl | D. | 二氧化硅的分子式为:SiO2 |
分析 A.次氯酸分子中不存在氢氯键,其分子中存在1个氧氢键和一个氧氯键;
B.硫离子有三个电子层,最外层8个电子;
C.原子符号中质量数标注在元素符号左上角,质子数表在元素符号左下角,质量数=质子数+中子数;
D.二氧化硅是原子构成的化合物.
解答 解:A.次氯酸分子中存在1个O-H键和一个O-Cl键,其电子式为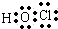 ,将共用电子对换成短线即为次氯酸的结构式,所以次氯酸正确的结构简式为:H-O-Cl,故A错误;
,将共用电子对换成短线即为次氯酸的结构式,所以次氯酸正确的结构简式为:H-O-Cl,故A错误;
B.硫离子的结构示意  ,故B正确;
,故B正确;
C.质量数为37的氯原子,质子数为17,元素符号3717Cl,故C错误;
D.二氧化硅是原子构成的化合物无分子式,化学式:SiO2 ,故D错误;
故选B.
点评 本题考查了结构式、离子结构示意图、原子符号等化学用语的判断,题目难度中等,注意掌握常见化学用语的表示方法,试题有利于培养学生灵活应用所学知识的能力.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:实验题
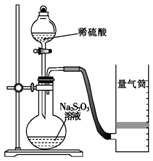 下面是某同学测定化学反应速率并探究其影响因素的实验.
下面是某同学测定化学反应速率并探究其影响因素的实验.| 实验序号 | 体积V/mL | 时间/s | |||
| Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
| ① | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
| ② | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
| ③ | 6.0 | 2.0 | 4.0 | Vx | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸分子的结构式: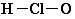 | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: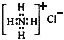 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeS2 | B. | CaC2 | C. | BaO2 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通过化学变化可以实现16O与18O之间的转化 | |
| B. | 因为H2O的沸点高于H2S,所以O原子得电子能力大于S原子 | |
| C. | 某化合物熔融状态下能导电,该化合物中一定有离子键 | |
| D. | 化学键是相邻分子之间的强烈的相互作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②③⑤⑦ | C. | ②③⑥⑧ | D. | ②④⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为297.23 kJ/mol | |
| B. | 形成1 mol SO2的化学键所释放的总能量大于断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量 | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.23 kJ | |
| D. | 1mol SO2的总能量小于 1mol S(s)和1mol O2(g)的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用澄清石灰水检验CO中是否含有CO2 | |
| B. | 用BaCl2除去NaOH溶液中混有的少量Na2SO4 | |
| C. | 用酒精把碘水中的碘萃取出来 | |
| D. | 用溶解、过滤的方法分离CaCl2和NaCl固体混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com