
能正确表示下列反应的离子方程式是( )
A.向NaAlO2溶液加入NaHCO3溶液:HCO3-+AlO2-+H2O==CO32-+Al(OH)3↓
B.实验室制备氢氧化铁胶体:Fe3++3H2O==Fe(OH)3↓+3H+
C.在FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2==2Fe3++Br2+4Cl-
D.Na2O2溶于水产生O2:Na2O2+H2O===2Na++2OH-+O2↑
科目:高中化学 来源:2017届四川省成都市高三上学期一诊化学试卷(解析版) 题型:选择题
常温下,将0.1L0.1mol/L Na2S2O3溶液与一定量的pH=2的硫酸溶液混合,放出VL气体。NA代表阿伏加德罗常数的值,下列说法正确的足
A.pH=2的硫酸溶液含有H+数目为0.0lNA
B.该反应释放SO2分子数目为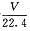 NA
NA
C.反应中每摩尔Na2S2O3转移的电子数目为4NA
D.若98gH2SO4溶于水完全电离,其断裂的共价键数目为2NA
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:选择题
在体积恒定的密闭容器中,一定量的SO2与1.25mol O2在催化剂作用下加热到600℃发生反应:2SO2(g)+O2(g) 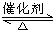 2SO3(g) △H<0。当气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是( )
2SO3(g) △H<0。当气体的物质的量减少0.45mol时反应达到平衡,在相同的温度下测得气体压强为反应前的80%。下列有关叙述正确的是( )
A.该温度下的平衡常数为101.25 L/moL
B.达到平衡时,SO2的转化率是90%
C.降低温度,正反应速率减小程度比逆反应速率减小程度大
D.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量一定为231.4g
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三上联考四化学试卷(解析版) 题型:选择题
我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金……其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )
A.氨水 B.硝酸 C.醋 D.卤水
查看答案和解析>>
科目:高中化学 来源:2017届湖北省孝感市高三上第一次统考化学试卷(解析版) 题型:实验题
甲醇是重要的工业原料。煤化工可以利用煤炭制取水煤气从而合成甲醇:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
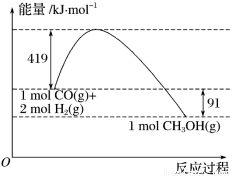
已知①常压下反应的能量变化如图所示。
②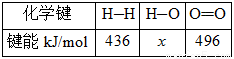
③CO(g)+1/2O2(g)===CO2(g) ΔH=-280kJ/mol
H2(g)+1/2O2(g)===H2O(l) ΔH=-284kJ/mol
H2O(l)===H2O(g) ΔH=+ 44kJ/mol
请回答下列问题:
(1)请写出表示气态甲醇燃烧热的热化学方程式_________________________。
(2)H—O键的键能x为_________kJ/mol。
(3)甲醇气体分解为CO和H2两种气体的反应的活化能为_________kJ/mol。
(4)在________(填“高温”或“低温”)情况下有利于CO和H2制备甲醇的反应自发进行。
(5)某兴趣小组同学利用甲醇燃料电池探究电浮选法处理污水的一种方式:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH )3沉淀。Fe(OH)3具有吸附性,可吸附污物而沉积下来,具有净化水的作用。装置如右图所示。
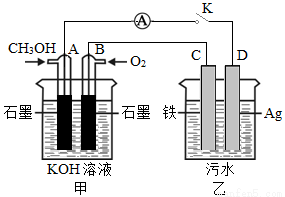
①写出甲池的A极电极反应式:______________________。
②若乙池实验时污水中离子浓度较小,导电能力较差,净水效果不好,此时应向污水中加入适量的_______。
A.H2SO4
B.BaSO4
C.Na2SO4
D.NaOH
E.CH3CH2OH
查看答案和解析>>
科目:高中化学 来源:2017届湖北省孝感市高三上第一次统考化学试卷(解析版) 题型:选择题
分子式为C7H6O2且属于芳香族化合物的同分异构体数目是( )
A.2 B.3 C.4 D.5
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一12月月考化学试卷(解析版) 题型:实验题
氧化镁、氧化铝的熔点高,常作耐高温材料。以MgC12和AlCl3的混合液为主要原料,设计实验制备氧化镁、氧化铝。实验步骤如下:
Ⅰ.取混合液于烧杯中,加入过量的氢氧化钠溶液,充分搅拌,静置;
Ⅱ.过滤得到沉淀和滤液;洗涤、灼烧,得到固体X;
Ⅲ.在步骤Ⅱ所得滤液中加人足量盐酸,再滴加过量的浓氨水;
Ⅳ.过滤、洗涤、灼烧,得到固体Y 。
(1)固体X的名称是_______。
(2)写出步骤Ⅰ中的离子反应方程式:________;________。
(3)步骤Ⅱ过滤中使用的三种玻璃仪器分别为烧杯、漏斗、______。
(4)步骤Ⅲ中,能否使用氢氧化钠溶液替代浓氨水_____(填“能”或“否”)。
(5)写出步骤Ⅳ中“灼烧”发生的化学反应方程式:___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一12月月考化学试卷(解析版) 题型:选择题
极据下列反应判断微粒的还原性由强到弱的顺序正确的是( )
①Cl2+2KI=I2+2KCl ②2FeCl3+2KI=I2+2FeCl2+2HCl
③2FeCl2+ Cl2=2FeCl3 ④I2+SO2+2H2O=2HI+H2SO4
A.Cl->I->Fe2+>SO2 B.Fe2+>Cl->I->SO2
C.SO2>I->Fe2+>Cl- D.SO2>Fe2+ I->Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省钦州市钦州港区高一12月月考化学卷(解析版) 题型:推断题
甲、乙、丙为常见单质。A、B、C、D、E、F、G、H均为中学化学中常见的化合物,其中B、G的焰色反应均为黄色,C能使品红溶液褪色。在一定条件下,各物质相互转化关系如图所示。
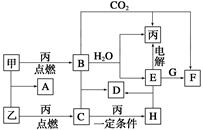
请回答下列问题:
(1)用化学式表示:丙为__________,H为__________。
(2)A的电子式为________________________________。
(3)电解E的水溶液时,E起到的作用是________________________。
(4)写出B+C—→D的化学方程式:_____________________________;
写出E+G—→F的离子方程式:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com