
 .
.分析 五种短周期元素A、B、C、D、E的原子序数依次增大,A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为H元素、B为N元素;A和C同族,C的原子序数大于N元素,故C为Na元素;B和D同族,则D为P元素;单质E在工业生产中用于制漂白粉,则E为Cl元素,据此解答各小题即可.
解答 解:五种短周期元素A、B、C、D、E的原子序数依次增大,A和B形成的共价化合物在水中呈碱性,该化合物为NH3,则A为H元素、B为N元素;A和C同族,C的原子序数大于N元素,故C为Na元素;B和D同族,则D为P元素;单质E在工业生产中用于制漂白粉,则E为Cl元素,根据分析可知:A为氢、B为氮、C为钠、D为磷、E为氯,
(1)D元素为P,原子序数为15,处于周期表中第三周期第ⅤA族,
故答案为:第三周期第ⅤA族;
(2)N、Na、P元素原子半径,同一周期中,原子序数越小,半径越大,周期数越大,半径越大,故N、Na、P的原子半径由大到小的顺序是:Na>P>N,
故答案为:Na>P>N;
(3)H和Cl形成的化合物为HCl,H和N形成的化合物为氨气,两者反应生成氯化铵,产物的化学式为NH4Cl,氯化铵为离子化合物,其电子式为: ,
,
故答案为: ;
;
(4)漂白粉的主要成分为次氯酸钙,次氯酸钙能够与空气中二氧化碳反应导致失效,反应方程式为:Ca(ClO)2+H2O+CO2=CaCO3+2HClO 或Ca(ClO)2+2H2O+2CO2=Ca(HCO3)2+2HClO,
故答案为:Ca(ClO)2+H2O+CO2=CaCO3+2HClO 或Ca(ClO)2+2H2O+2CO2=Ca(HCO3)2+2HClO;
(5)a.N和P的单质的熔点高低与其非金属性无关,故a错误;
b.N和P的氢化物的稳定性强弱可以比较N与P的非金属性强弱,氢化物越稳定,非金属性越强,故b正确;
c.N和P的单质与氧气反应的难易,不能证明非金属性强弱,故c错误;
d.N和P的最高价氧化物对应的水化物的酸性强弱可以比较,酸性越强,非金属性越强,故d正确;
故答案为:bd;
(6)A与B形成的化合物为氨气,氨气在液态时与C单质Na反应生成NaNH2和氢气,反应的化学方程式为:2Na+2NH3=2NaNH2+H2↑,
故答案为:2Na+2NH3=2NaNH2+H2↑.
点评 本题考查了位置、结构与性质关系的综合应用,题目难度中等,推断各元素为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意熟练掌握元素周期表结构与元素周期律内容.


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:多选题
| A. | 微粒半径:Na+>K+>Cl->S2- | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO4 | D. | 熔点:Al>Mg>Na>K |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
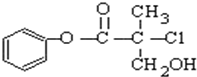
| A. | l mo1 A和足量的H2发生加成反应,最多可以消耗3 mol H2 | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | l mo1 A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质常用作半导体材料和光导纤 | B. | 在自然界中以化合态的形式存在 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
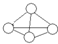 白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )
白磷分子如图所示,则31g白磷分子中存在的共价键数目是( )| A. | 4NA | B. | NA | C. | 1.5NA | D. | 0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VIIA | O |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | (10) | (11) | (12) |
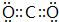
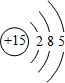 .
.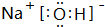 含有化学键为离子键、共价键
含有化学键为离子键、共价键查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com