
分析 (1)由氧化还原反应方程式中元素化合价的改变判断出原电池的负极是Zn,正极是Ag2O,电解质溶液可选氢氧化钠溶液,据此设计;
(2)由氧化还原反应方程式中元素化合价的改变判断出原电池的负极是Pb,正极是PbO2,电解质溶液应为稀硫酸,据此设计.
解答 解:(1)由方程式Zn+Ag2O+H2O=Zn(OH)2+2Ag可知Zn元素化合价升高,被氧化,应为原电池的负极,总反应中生成的是氢氧化锌,所以电解质溶液选择碱液如氢氧化钠溶液,电极反应式为:Zn+2OH--2e-═Zn(OH)2,根据Ag2O中Ag元素化合价降低,被还原,Ag2O为原电池的正极,总反应减去负极得到正极电极反应式为:Ag2O+H2O+2e-═2Ag+2OH-;装置图为: ,
,
故答案为:Ag2O+H2O+2e-═2Ag+2OH-;Zn+2OH--2e-═Zn(OH)2; ;
;
(2)由方程式Pb+PbO2+2H2SO4=2PbSO4+2H2O可知Pb元素化合价升高,被氧化,应为原电池的负极,负极是Pb,负极反应式为Pb+SO42--2e-═PbSO4,根据PbO2中Pb元素化合价降低,被还原,正极是PbO2,正极反应式为SO42-+PbO2+2e-+4H+═PbSO4+2H2O, ,
,
故答案为:SO42-+PbO2+2e-+4H+═PbSO4+2H2O;Pb+SO42--2e-═PbSO4; .
.
点评 本题考查了原电池原理,原电池设计等知识,要知道哪些反应能设计成原电池,根据反应中元素化合价变化确定正负极、电解质溶液,原电池设计是学习难点,也是考试热点.


科目:高中化学 来源: 题型:选择题
| A. | 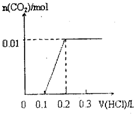 | B. | 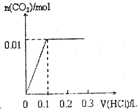 | C. | 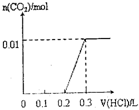 | D. | 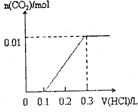 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应3Br2+3CO32-=5Br-+BrO3-+3CO2↑中,每生成3 mol CO2转移的电子数为5NA | |
| B. | 0.5 mol 甲基中电子数为5NA | |
| C. | 常温下,1 L 0.1 mol/L的NH4NO3溶液中氢原子总数为0.4NA | |
| D. | 常温常压下,22.4 L N2H4中N-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CCl4、PCl5、CS2分子中所有原子都满足最外层为8个电子稳定结构 | |
| B. | 三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,因此三氯化铁晶体是离子晶体 | |
| C. | Na3N与NaH均为离子化合物,都能与水反应放出气体,且与水反应所得溶液均能使酚酞试液变红 | |
| D. | SO2、H2O都是由极性键形成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽马鞍山二中高一10月阶段测化学卷(解析版) 题型:选择题
在相同状况下,一个空瓶,若装满O2称其质量为36 g,若装满CO2称其质量为42 g,若装满A气体,称其质量为52 g,则A的相对分子质量是
A.16 B.32 C.64 D.128
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三上定时训练8化学卷(解析版) 题型:实验题
氯化亚铜(CuCl)为白色粉末,微溶于水。常用作有机合成催化剂,并用于颜料、防腐等工业。实验室可采用亚硫酸钠还原氯化铜的方法制备氯化亚铜,主要流程如图所示:

(1)上述方法制备氯化亚铜的化学方程式为_________________。
(2)下图是加热蒸发滤液,回收Na2SO4的装置。装置图中存在一处严重错误,该错误是_____________。

(3)洗涤产品氯化亚铜沉淀的试剂是____________,检验沉淀是否洗涤干净的方法是_______________。
(4)CuCl的盐酸溶液能吸收一氧化碳而生成氯化羰基亚铜[Cu2Cl2(CO)2·2H2O]。下图是用CO(含有CO2杂质)还原CuO并验证其氧化产物的实验装置图。
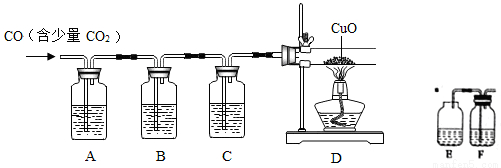
装置A中盛装的是饱和NaOH溶液,该装置的作用是______________,装置B盛有澄清的石灰水,其中装置B的作用是_____________,盛装CuCl的盐酸溶液的装置是__________(选填装置中提供的装置字母代号)。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
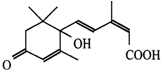 节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A. | 1mol该物质与足量金属钠完全反应产生2mol H2 | |
| B. | 该物质能与FeCl3溶液发生显色反应 | |
| C. | 1mol该物质最多与5 mol氢气加成 | |
| D. | 既能发生加聚反应,又能发生酯化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com