
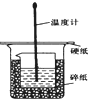
 50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:
50ml0.50mol?L-1盐酸与50mL0.55mol?L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程 中放出的热量可计算中和热.回答下列问题:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

| A、铁电极上的电极反应式为Fe-2e-=Fe2+ |
| B、溶液中Na+由石墨电极向铁电极移动 |
| C、通电一段时间后,可看到铁电极附近溶液变红 |
| D、通电一段时间后,可看到试管中溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化还原反应中,一种元素化合价升高,一定有另一种元素化合价降低 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、根据水溶液能否导电将化合物分为电解质和非电解质 |
| D、碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | 最外层电子数是内层电子数的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.甲醇是一种新型的能源.
Ⅰ.甲醇是一种新型的能源.| nA |
| tA |
| n(H2) |
| n(CH3OH ) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.24 L C4H6中含有碳碳叁键数一定为0.1×6.02×1023 |
| B、在标准状态下,11.2 L NO与11.2 L O2混合后气体分子数为0.75NA |
| C、含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| D、120g NaHSO4固体中的离子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由H2、I2(g)、HI组成的平衡体系,加压(缩体积)后颜色加深 |
| B、开启啤酒瓶后,瓶中马上泛起大量泡沫 |
| C、实验室中常用排饱和食盐水的方法收集氯气 |
| D、合成氨中增加N2的物质的量浓度可提高H2的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com