
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2HBr(g);ΔH<0,
2HBr(g);ΔH<0,
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2g的转化率为b。a与b
的关系是
A.a>b B.a=b
C.a<b D.无法确定
科目:高中化学 来源: 题型:
元素周期表中第ⅦA族元素的单质及其化合物的用途广泛.
(1)与氯元素同族的短周期元素的原子结构示意图为 .
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成Ⅰ中反应的总化学方程式: NaCl+ H2O═ NaClO3+ .
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其他晶体析出的原因是 .
(4)一定条件下,在水溶液中1mol Cl﹣、ClOx﹣(x=1,2,3,4)的能量(kJ)相对大小如图所示.

①D是 ﹣ (填离子符号).
②B→A+C反应的热化学方程式为 (用离子符号表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下的密闭容器中,可逆反应2A(g)B(g)+3C(g)在下列四种状态中处于平衡状态的是( )
| 反应速率 | A | B | C | D |
| v(正)/mol·(L·min)-1 | v(A)=2 | v(A)=1 | v(A)=1 | v(A)=2 |
| v(逆)/mol·(L·min)-1 | v | v(B) =1.5 | v(C) =1.5 | v(C) =2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢 H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正 确的是( )
确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积恒定的密闭容器中,一定量的SO2与1.100 mol O2在催化剂作用下加热到600 ℃
发生反应:2SO2+O2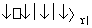 2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是 ( )
2SO3 ΔH<0。当气体的物质的量减少0.315 mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%。下列有关叙述正确的是 ( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的质量为161.980 g
D.达到平衡时,S O2的转化率为90%
O2的转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中曲线变化不正确的是

A.①表示Na2CO3溶液中滴入稀盐酸
B.②表示溴水中滴入Na2SO3溶液
C.③表示HCl和MgCl2溶液中滴入氨水
D.④表示一定条件下反应:2SO2+O2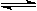 2SO3 ΔH< 0 ,达平衡后,增大压强
2SO3 ΔH< 0 ,达平衡后,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中进行如下反应:
N2+3H2 2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
2NH3,若将平衡体系中各物质的浓度都增加到原来的2倍,则产生的结果是
A.平衡不发生移动 B.平衡沿着逆反应方向移动
C.正逆反应速率都增大 D.NH3的质量分数增加

查看答案和解析>>
科目:高中化学 来源: 题型:
将0.23 mol SO2和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应
2SO2+O2 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K=
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K=
______________。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度__________(填“增
大”“不变”或“减小”),氧气的转化率________(填“升高”“不变”或“降低”),SO3的体积分数________(填“增
大”“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
【实验】制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是________。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:
________________________________________________________________________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容
(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① | |
| ② | |
| …… | 若银镜消失,假设2成立。 |
| 若银镜不消失,假设2不成立。 |
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO3-都氧化了Ag。
你是否同意丙同学的结论,并简述理由:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com