
(1)元素A是第三周期ⅦA族元素,A元素与另两种非金属元素可组成离子化合物甲。写出甲的化学式________。
(2)在所有的气态氢化物中,元素B的氢化物最稳定,写出元素B在周期表中的位置____________________ 。
(3)金属元素C形成的某化合物的溶液常用于检验CO2,则元素C的简单离子与元素A的简单离子的半径大小关系是________ (用离子符号表示),元素D的原子序数比元素C小8,写出元素D的单质在CO2中燃烧的化学方程式________ 。
(4)元素E是第三周期中简单离子半径最小的元素,元素F是第三周期中原子半径最大的元素,写出元素E的单质与元素F的最高价氧化物对应水化物反应的的离子方程式__________________ 。
科目:高中化学 来源: 题型:
可逆反应2SO2(g)+O2(g)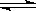 2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是:
2SO3(g)从正方向开始,并达到了平衡,此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是:
A.新平衡体系中,SO2和O2物质的量之比仍为2∶1
B.平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小
C.新平衡体系与旧平衡体系比较,SO3的浓度肯定增大
D.若所采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
请认真观察右图,然后回答问题:
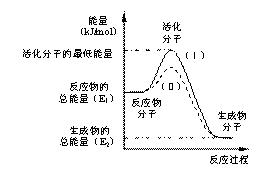 (1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=___________ (用含E1、E2的代数式表示)。
(1)图中所示反应是_________(填“吸热”或“放热”)反应,该反应的△H=___________ (用含E1、E2的代数式表示)。
(2)已知热化学方程式:
H2(g)+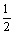 O2(g)= H2O(g)
O2(g)= H2O(g)
△H=-241.8 kJ/mol,
该反应的活化能为167.2 kJ/mol,则其逆反应的活化能为_______________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能 ,活化分子百分数 ,反应速率 ,(Ⅱ)相对(Ⅰ)改变的外界条件是_________。这一改变对反应热_________(填“有”、“无”)影响,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质比较,正确的是( )
A.酸性:H2SO4>HClO4 B.碱性:NaOH>KOH
C.非金属性: P>S D.气态氢化物稳定性: HCl>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素。下列说法不正确的是( )
A.化合物YZ3极易溶解于水
B.Z与M可以形成共价化合物
C.12 g 14X中含有质子的物质的量为6 mol
D.由上述四种元素组成的离子化合物受热易分解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于煤、石油、天然气等资源的说法正确的是 ( )。
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
将图中所列仪器组装为一套蒸馏石油的实验装置,并进行蒸馏,得到汽油和煤油。
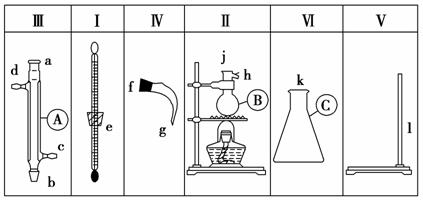
(1)图中A、B、C三种仪器的名称分别是________、________、________。
(2)将以上仪器组装为一套蒸馏石油的实验装置用字母a,b,c,…表示连接顺序:
e接( );( )接( );( )接( );( )接( )。
(3)A仪器中c口用于________,d口用于________。
(4)蒸馏时,温度计水银球应在________位置。
(5)在B中注入原油后,加几片碎瓷片的目的是____________________ __________________________________________________。
(6)给B加热,收集到沸点为60~150 ℃间的馏分是________,收集到150~300 ℃间的馏分是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,
并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:
2H2O 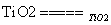 2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,二氧化钛作________,生成的氢气用于燃料电池时,______
能转变为________能。分解海水的反应属于______反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:
A极:2H2+2O2--4e-===2H2O B极:O2+4e-===2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
向100 mL 0.1 mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1 mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是( )
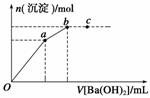
A.a点时溶液中所含主要溶质为(NH4)2SO4
B.a→b段发生反应的离子方程式是: SO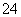 +Ba2+===BaSO4↓
+Ba2+===BaSO4↓
C.b点为最大沉淀量,对应的纵坐标值为0.02
D.c点加入Ba(OH)2溶液的体积为200 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com