
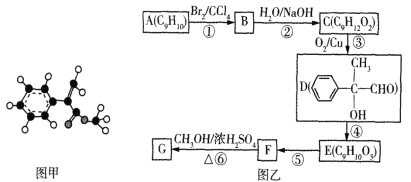
【题目】化合物G是一种重要的有机合成原料,其球棍模型如图甲所示。该化合物可用芳香烃A为原料来合成,其合成路线如图乙所示:
(1)下列关于G的说法不正确的是___(填标号)。
a.G的结构简式为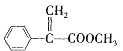
b.G能使酸性高锰酸钾溶液和溴水褪色,褪色原理相同
c.G的分子中所有碳原子可能处于同一平面内
d.G在一定条件下能发生水解、加成、加聚、氧化等反应
(2)F中的官能团名称为___,E的结构简式为___。
(3)反应①~⑥中属于取代反应的有___(填标号)。
(4)D的核磁共振氢谱的峰面积之比为____。
(5)写出D与银氨溶液反应的化学方程式:____。
(6)写出同时符合下列条件的F的同分异构体的结构简式:___(不考虑立体异构)。
a.分子内含苯环
b.苯环上只有一个支链
c.能发生银镜反应和水解反应
【答案】b 碳碳双键、羧基  ②⑥ 2:2:1:1:1:3
②⑥ 2:2:1:1:1:3 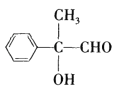 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
 +2Ag+3NH3+H2O
+2Ag+3NH3+H2O 
【解析】
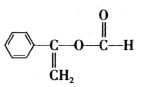
根据框图中的反应条件、分子式和结构简式知,A到B发生加成反应,B到C发生水解反应,C到D是醇羟基发生催化氧化反应,由D的结构简式为 ,逆推C的结构简式为
,逆推C的结构简式为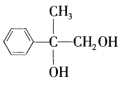 ,逆推B的结构简式为
,逆推B的结构简式为 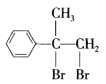 ,逆推A的结构简式为
,逆推A的结构简式为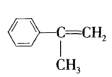 ,由D的结构知道D的分子式为C9H10O2,E的分子式为C9H10O3,可知D到E是醛基发生催化氧化反应,则E的结构简式为
,由D的结构知道D的分子式为C9H10O2,E的分子式为C9H10O3,可知D到E是醛基发生催化氧化反应,则E的结构简式为 ,由G球棍模型如图甲所示,可以推出G的结构简式为
,由G球棍模型如图甲所示,可以推出G的结构简式为 ,根据反应条件,可知F到G是发生酯化反应,由G的结构逆推F的结构简式为
,根据反应条件,可知F到G是发生酯化反应,由G的结构逆推F的结构简式为 ,E到F发生消去反应,据此解答。
,E到F发生消去反应,据此解答。
(1)a.由上述分析可知,G的结构简式为 ,故a正确;
,故a正确;
b.根据G的结构,G中含有碳碳双键,能与溴水中的溴发生加成反应而使溴水褪色,也能与酸性高锰酸钾溶液发生氧化还原反应而使酸性高锰酸钾溶液褪色,二者褪色原理不相同,故b错误;
c.G分子中含有碳碳双键,与其直接相连的碳原子一定处于同一平面内,苯环为平面结构,故苯环上的碳原子也可能处于碳碳双键所在的平面内,与酯基相连的甲基碳原子也可能处于该平面内,故G的分子中所有碳原子可能处于同一平面内,c正确;
d.根据G的结构中含有碳碳双健和酯基官能团,则G可发生水解、加成、加聚、氧化等反应,故d正确;
答案为b。
(2)F的结构简式为 ,它含有碳碳双键、羧基官能团,E的结构简式为
,它含有碳碳双键、羧基官能团,E的结构简式为 ;答案为碳碳双键、羧基,
;答案为碳碳双键、羧基, 。
。
(3)由上述分析可知,反应①属于加成反应,反应②属于取代反应,反应③属于氧化反应,反应④属于氧化反应,反应⑤属于消去反应,反应⑥属于取代反应,则属于取代反应的为②⑥;答案为②⑥。
(4)由D的结构简式为 知苯环上有3种氢,峰面积之比为2:2:1,取代基上有3种氢,峰面积之比为1:1:3,共有6种不同环境的H,峰面积之比为2:2:1:1:1:3;答案为2:2:1:1:1:3。
知苯环上有3种氢,峰面积之比为2:2:1,取代基上有3种氢,峰面积之比为1:1:3,共有6种不同环境的H,峰面积之比为2:2:1:1:1:3;答案为2:2:1:1:1:3。
(5)D的结构简式为 ,其与银氨溶液反应的化学方程式为
,其与银氨溶液反应的化学方程式为 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
 +2Ag+3NH3+H2O;答案为
+2Ag+3NH3+H2O;答案为 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
 +2Ag+3NH3+H2O。
+2Ag+3NH3+H2O。
(6)F的结构简式为 ,符合下列条件的同分异构体,分子内含苯环,苯环上只有一个支链,能发生银镜反应说明含有-CHO,能发生水解反应说明含有
,符合下列条件的同分异构体,分子内含苯环,苯环上只有一个支链,能发生银镜反应说明含有-CHO,能发生水解反应说明含有![]() ,由氧原子个数,可判断是甲酸某酯,符合条件的同分异构体为
,由氧原子个数,可判断是甲酸某酯,符合条件的同分异构体为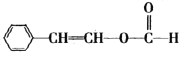 ,
, ;答案为
;答案为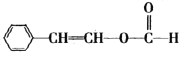 ,
, 。
。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容容器中发生N2O4(g)2NO2(g),若反应物的浓度由0.1molL﹣1降到0.06molL﹣1需20s,那么由0.06molL﹣1降到0.036molL﹣1,所需反应时间为( )
A. 10 sB. 12 sC. 大于12 sD. 小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海南粗榧新碱是从植物中提取的、具有边缘抗肿瘤活性的生物碱,合成该碱的一种常见中间体G的合成线路如图:

已知:①R—COOH+R’—OH ![]()
![]() +H2O
+H2O
②R—CN
回答下列问题:
(1)X为醛类物质,其名称为_________。
(2)B→C的反应类型为_________。
(3)D→E的反应方程式为_________。
(4)化合物F的结构简式为_________。
(5)有机物Y是A的同分异构体,满足下列条件的Y还有_________种。
①能与FeC13溶液发生显色反应
②1 mo1 Y与足量金属Na反应生成1 mo1 H2
③结构中含“![]() ”
”
其中核磁共振氢谱显示为4组峰,且峰面积比为2:2:1:1的物质为_________(写出其中一种结构简式)。
(6)设计以![]() 为起始原料制备
为起始原料制备 的合成线路__________(无机试剂任选)。
的合成线路__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl—)与c(SO42—)之比为( )
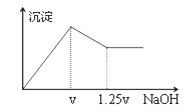
A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在105℃时1L两种气态混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积为10.5L,再将气体通过碱石灰,体积缩小6L。则下列各组混合烃中符合此条件的是
A.CH4,C2H6B.C2H4,C3H8C.C2H4,C3H6D.C2H2,C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝、铁是常见的金属,其化合物也有广泛的用途。回答下列问题:
(1)氢氧化铝是一种两性氢氧化物,写出它的电离方程式___,将少量的稀盐酸逐渐滴入NaAlO2溶液,产生的现象为___,用平衡移动原理来解释这一现象:___。
(2)明矾可以用于净水,用离子反应方程式来解释原理:___,将Ba(OH)2溶液滴入明矾溶液中,当SO42-完全沉淀,则铝元素在溶液中存在的形式为___(用化学式表示)。
(3)高铁酸钠(Na2FeO4)可用作高效水处理剂,既可以杀菌消毒,又可以除去水中的悬浮颗粒物,请用你所学过的化学原理加以解释。___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将氨气通入水中,发生化学反应的方程式有_______;下列有关分析中正确的是_______;
A.常温时氨气易溶于水
B.通常情况下氨气在水中的溶解度不大
C.溶于水的氨气分子有少量发生电离
D.氨水中的NH3H2O可电离出少量OH-
E.氨本身具有弱碱性
F.在饱和氨水中含量最多的溶质是NH3H2O
(2)氨水有许多用途,请任写一个用氨水制取不溶性碱的方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+
O2(g) = CO(g) ΔH=—110.5 kJ/mol;CO(g)+![]() O2(g) = CO2(g) ΔH=—283 kJ/mol。与这些碳完全燃烧相比,损失的热量是 ( )
O2(g) = CO2(g) ΔH=—283 kJ/mol。与这些碳完全燃烧相比,损失的热量是 ( )
A.172.5 kJB.110.5 kJC.283 kJD.566 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.10mol·L-1一元弱酸HA(Ka=10-3)中逐滴加入0.10mol·L-1的NaOH溶液,溶液pH随所加NaOH溶液体积变化如图。下列说法不正确的是( )
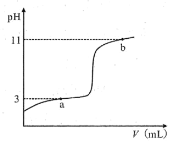
A.a点处存在c(HA)+c(OH-)=c(Na+)+c(H+)
B.b点处存在c(Na+)=c(HA)+c(OH-)+c(A-)
C.由a→b,溶液中n(A-)持续增大
D.V=10mL时,存在c(Na+)>c(A-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com