
 原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答:
原儿茶醛是制造医药及染料的中间体,可用于制造多种抗菌素和消炎药物.其结构如图:请回答: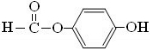 .
. .
. 分析 (1)根据结构简式可知有机物中含有酚羟基和醛基;
(2)能与氢气发生加成反应的有苯基和醛基;
(3)根据结构简式判断分子式,根据含有的官能团判断可能具有的性质;
(4)能发生水解反应,说明应含有酯基,能使FeCl3显紫色,说明含有酚羟基,在核磁共振氢谱中出现四组峰,其氢原子数之比为1:2:2:1,说明苯环上有两个取代基,且处于对位位置;
(5)原儿茶醛含有醛基,在碱性条件下与氢氧化铜发生氧化还原反应.
解答 解:(1)根据结构简式可知有机物中含有-OH和-CHO,为羟基和醛基,故答案为:羟基、醛基;
(2)能与氢气发生加成反应的有苯基和醛基,则1mol原儿茶醛最多能与4molH2发生加成反应,故答案为:4;
(3)分子中含有醛基,能发生银镜反应,含有酚羟基,具有酸性,可与NaOH反应,分子式为 C7H6O3,则正确的是②③,故答案为:②③;
(4)能发生水解反应,说明应含有酯基,能使FeCl3显紫色,说明含有酚羟基,在核磁共振氢谱中出现四组峰,其氢原子数之比为1:2:2:1,说明苯环上有两个取代基,且处于对位位置,应为 ,
,
故答案为: ;
;
(5)原儿茶醛含有醛基,在碱性条件下与氢氧化铜发生氧化还原反应,反应的方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的结构和性质,为高频考点,题目难度不大,注意把握有机物的官能团的种类和性质,为解答该题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象可用来区别胶体与溶液 | |
| B. | 溶液、胶体、浊液的根本区别是分散质粒子直径的大小 | |
| C. | 胶体在一定条件下会发生聚沉 | |
| D. | 胶体粒子能通过半透膜,不能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变某一条件,使v(正)、v(逆)均改变,化学平衡一定移动 | |
| B. | 改变某一条件,使v′(正)>v′(逆)不变,化学平衡一定逆向移动 | |
| C. | 改变某一条件,使v′(正)增大,v′(逆)不变,化学平衡一定正向移动 | |
| D. | 改变某一条件后,v′(正)、v′(逆)同时增大或同时减小时,化学平衡不移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3的VSEPR模型为四面体形 | B. | PH3分子中P原子采取sp2杂化 | ||
| C. | PH3分子中P原子上有1个孤电子对 | D. | PH3分子的立体构型是三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +3 | B. | +2 | C. | -2 | D. | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜片表面有气泡生成 | |
| B. | 装置中存在“化学能→电能→光能”的转换 | |
| C. | 如果将锌片换成铁片,电路中的电流方向不变 | |
| D. | 如果将稀硫酸换成柠檬汁,导线中不会有电子流动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )和D(
)和D( )按如下方法合成:
)按如下方法合成:
 +RCH2I→
+RCH2I→ +NaI
+NaI ;
; ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com