
 回答下列问题:
回答下列问题:分析 (1)Na2SO3溶液吸收SO2气体生成NaHSO3;常温下SO32-水解使得溶液显碱性,且分步水解,据此可写出水解反应离子方程式;
(2)①计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v(正)、v(逆)相对大小;
②恒温恒压下,压强之比等于物质的量之比,计算平衡时混合气体总物质的量,再利用差量法计算转化的二氧化硫物质的量,进而计算二氧化硫转化率;
③A.保持温度和容器体积不变,充入1.0 mol O2,平衡正向移动;
B.保持温度和容器内压强不变,充入1.0 mol SO3,与原平衡为等效平衡,平衡时相同组分的浓度相等;
C.降低温度,平衡正向移动,平衡常数增大,容器的容积减小,三氧化硫的浓度增大,由于体系中二氧化硫与氧气的浓度之比为2:1,故二者浓度增大;
D.移动活塞压缩气体,压强增大,平衡正向移动,三氧化硫浓度增大,平衡常数不变,二氧化硫与氧气浓度均增大;
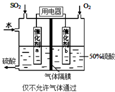
(3)用电化学原理生产硫酸,气体隔膜不能使气体通过,右侧通入氧气,发生还原反应,左侧发生氧化反应,SO2电极上SO2失去电子氧化生成硫酸;
(4)原溶液为50%硫酸,则溶液中n(H2SO4):n(H2O)=$\frac{1}{98}$:$\frac{1}{18}$=9:49,结合电池总反应方程式为:2SO2+O2+2H2O=2H2SO4计算.
解答 解:(1)Na2SO3溶液吸收SO2气体生成NaHSO3,时发生反应的离子方程式为:SO2+SO32-+H2O=2HSO3-;Na2SO3为强碱弱酸盐,SO32-水解使得溶液显碱性,pH>7,且分步水解,水解反应离子方程式为SO32-+H2O?HSO3-+OH-;
故答案为:SO2+SO32-+H2O=2HSO3-;>;SO32-+H2O?HSO3-+OH-;
(2)①此时浓度商Qc=$\frac{0.0{3}^{2}}{0.0{3}^{2}×0.06}$=$\frac{50}{3}$>K=$\frac{10}{3}$,反应向逆反应进行,则v(正)<v(逆),
故答案为:<;
②恒温恒压下,压强之比等于物质的量之比,则平衡后混合气体物质的量为(2+1)mol×$\frac{1.6L}{2L}$=2.4mol,则:
2SO2(g)+O2(g)?2SO3(g)△n
2 1
1.2mol 3mol-2.4mol=0.6mol
则SO2的平衡转化率为$\frac{1.2mol}{2mol}$×100%=60%,
故答案为:60%;
③A.保持温度和容器体积不变,充入1.0 mol O2,平衡正向移动,SO2(g)平衡浓度比原来减小,故A正确;
B.保持温度和容器内压强不变,充入1.0 mol SO3,与原平衡为等效平衡,SO2(g)平衡浓度与原来相等,故B错误;
C.降低温度,平衡正向移动,平衡常数增大,容器的容积减小,三氧化硫的浓度增大,由于体系中二氧化硫与氧气的浓度之比为2:1,故二者浓度增大,故SO2(g)平衡浓度比原来增大,故C错误;
D.移动活塞压缩气体,压强增大,平衡正向移动,三氧化硫浓度增大,平衡常数不变,二氧化硫与氧气浓度均增大,故D错误,
故选:A;
(3)用电化学原理生产硫酸,气体隔膜不能使气体通过,右侧通入氧气,发生还原反应,左侧发生氧化反应,SO2电极上SO2失去电子氧化生成硫酸,电极反应式为:SO2失去电子氧化生成硫酸,SO2+2H2O-2e-=SO42-+4H+,
故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)原溶液为50%硫酸,则溶液中n(H2SO4):n(H2O)=$\frac{1}{98}$:$\frac{1}{18}$=9:49,
2SO2+O2+2H2O=2H2SO4
9mol 9mol 9mol
故通入SO2和水的质量比为9mol×64g/mol:(9mol+49mol)×18g/mol=16:29,
故答案为:16:29.
点评 本题考查盐类的水解、化学平衡计算与影响因素、平衡常数应用、电化学原理及有关计算等,(3)中C选项为易错点,学生容易考虑平衡移动,忽略体积变化,(5)中注意加入的水部分参加反应,利用总反应式进行计算,难度中.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | CO32-、Na+、K+ | B. | SO42-、Cl-、K+ | C. | Cl-、NO3-、K+ | D. | HCO3-、SO42-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 合成氨工业上常用下列方法制备H2:
合成氨工业上常用下列方法制备H2:| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 2.5 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com