
【题目】具有相同的电子层结构的四种微粒:aAn+、bB(n+1)+、cCn-、dD(n+1)-,关于A、B、C、D四种元素叙述正确的是
A.一定都是短周期元素
B.原子序数:B > A > C > D
C.单质的还原性:B > A
D.气态氢化物的稳定性:D > C
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室用NaClO4、NH4Cl等原料制取(部分物质的溶解度如图1、图2),其实验流程如图3:
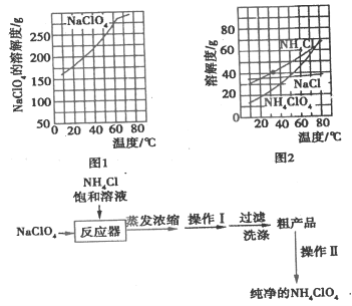
(1)反应器中发生反应的基本反应类型是________。
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为________。
(3)洗涤粗产品时,宜用________(填“0℃冷水”或“80°C热水”)洗涤。
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
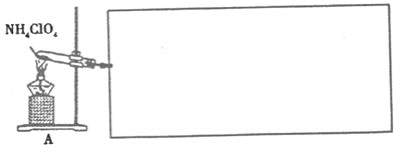
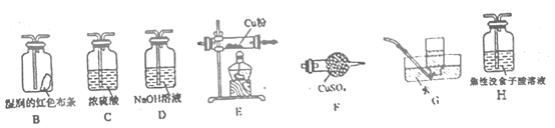
①写出高氯酸铵分解的化学方程式________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→________(填装置对应的字母),证明氧气存在的实验现象为________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学计量是化学学习的工具,请回答下列问题:
(1)标准状况下,1.7gNH3与__LH2S气体含有的氢原子数相同。
(2)VmLAl2(SO4)3溶液中含Al3+ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中SO42-的物质的量浓度是___mol/L。
(3)常温常压下22.4LCO2中分子个数__64克SO2的分子个数(填“>”、“<”或“=”)。
(4)标准状况下,33.6L的NH3所含电子的物质的量约为__mol。
(5)在一定温度和压强下,0.4mol某气体的体积为9.8L,则该条件下的气体摩尔体积为__。
(6)某盐混合溶液含有离子:Na+、Mg2+、Cl-、SO42-,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2molL-1、0.25molL-1、0.4molL-1,则c(SO42-)=___。
(7)标准状况下,NH3与CH4组成的混合气体的平均密度为0.75g/L,该混合气体的平均摩尔质量为___,NH3的体积分数(即NH3的体积与混合气体总体积的比值)为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
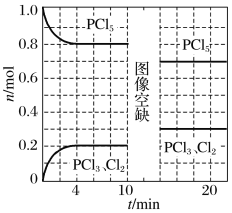
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)乙醇分子中C原子的杂化方式是_________
(4)[Cu(NH3)4]2+中,提供孤对电子的是________,Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是_______(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是_________。
(5)硫元素对应的含氧酸酸性是H2SO4
强于H2SO3,其原因为___________________。
(6)铜的一种氧化物晶体结构如图所示,
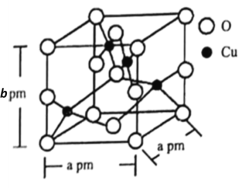
该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由苯乙烯经下列反应可制得B、H两种高分子化合物,它们都是常用的塑料。
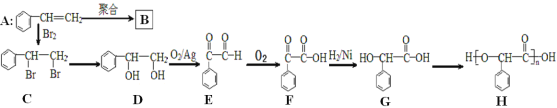
(1)G中所含官能团的名称为_____。
(2)聚合物B的结构简式是________;E的分子式是______________。
(3)C转化为D的化学方程式是_______________(应注明条件); F转化为G的反应类型属于______。
(4)写出G的一种符合下列条件的同分异构体X结简式_______________。
①X与FeCl3 溶液反应显色,也能发生银镜反应和水解反应,②X分子苯环上只有两个互为对位的取代基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y 和 Z 三种元素的原子序数之和等于 42。X 元素原子的 4p 轨道上有 3 个未成对电子,Y 元素原子的最外层 2p 轨道上有 2 个未成对电子。X 与 Y 可形成化合物X2Y3 ,Z 元素可形成负一价离子。下列说法正确的是( )
A.X 元素基态原子的电子排布式为[Ar]4s2 4p3
B.X 元素是第 4 周期第 VA 族元素
C.Z 元素的单质在氧气中不能燃烧
D.Y 元素基态原子的轨道表示式为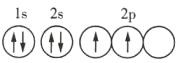
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下"Fe与水蒸气反应的实验"。
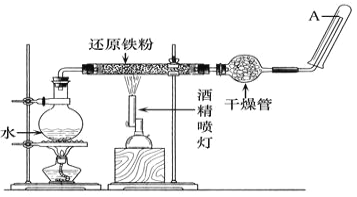
请回答该实验中的问题。
(1)实验前必须对整套装置进行气密性的检查,操作方法是_____________。
(2)圆底烧瓶中盛装的是水,该装置受热后的主要作用是_______________;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_______________。
(3)酒精灯和酒精喷灯点燃的顺序是__________。
(4)干燥管中盛装的物质可以是_____________,作用是__________。
(5)如果要在A处玻璃管口处点燃该气体,则必须对该气体进行_________,这一操作的目的_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com