
| A��̼��ȼ����Ϊ��H = �C110.5 kJ��mol��1 |
| B����Ӧ�ٵġ�H < 0����S > 0�����G < 0���������¶��·�Ӧ���Է����� |
| C����Ӧ���з�Ӧ����ܼ��ܴ�����������ܼ��� |
| D��ϡ������ϡNaOH��Һ��Ӧ����1 molˮ���ų���������57.3 kJ |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 �Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ����֪��
�Ļ����Һ���ܳ�ӡˢ��·�������ĩ�е�ͭ����֪�� ====
==== ��H=��64kJ/mol
��H=��64kJ/mol ====
==== ��H= -196kJ/mol
��H= -196kJ/mol ="==="
="==="  ��H= -286kJ/mol
��H= -286kJ/mol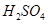 ��Һ��
��Һ�� ��
�� ��Ӧ����
��Ӧ���� ��
�� ���Ȼ�ѧ����ʽΪ ��
���Ȼ�ѧ����ʽΪ �� ��3.0 mol/L��
��3.0 mol/L��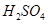 �����Һ��������ò�ͬ�¶���ͭ��ƽ���ܽ����ʣ����±�����
�����Һ��������ò�ͬ�¶���ͭ��ƽ���ܽ����ʣ����±�����| | �¶ȣ��棩 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| | ͭƽ���ܽ����� | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
| | �� �� �� | | | | | | | |
 ��Һ�м���һ������
��Һ�м���һ������ ��
�� ��Һ�����ȣ�����
��Һ�����ȣ����� �������Ʊ�
�������Ʊ� �����ӷ���ʽ�� ��
�����ӷ���ʽ�� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ÿ��ˮ�����ں���������� |
| B�������е�ˮ������ˮ�����ж�������� |
| C�����Ӽ����γ������ʹ���ʵ��۷е����� |
| D��HF�ȶ��Ժ�ǿ������Ϊ����Ӽ����γ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��926kJ | B��463 kJ | C��402.5kJ | D��23115 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ���ܰѷ�Ӧ���������õ�����ԭ���Ͼ����ܶ��ת�������ղ����У�
���ܰѷ�Ӧ���������õ�����ԭ���Ͼ����ܶ��ת�������ղ����У� CH3OH(g) ��H1
CH3OH(g) ��H1 CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2 (g) ��H ����1275.6 kJ��mol-1
(g) ��H ����1275.6 kJ��mol-1
 mol�״���
mol�״����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��HCl��NaOH��Ӧ���к� ����H2SO4��Ba��OH��2��Ӧ���к���Ϊ�� ����H2SO4��Ba��OH��2��Ӧ���к���Ϊ�� |
| B��CO��g����ȼ������283.0kJ/mol����2CO2��g��=2CO��g��+O2��g���ġ�H=+566.0kJ/mol |
C����101kPa��25��ʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ�����������ʾ����ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g��=2H2O��l��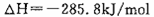 |
| D��1mol����ȼ��������̬ˮ�Ͷ�����̼���ų��������Ǽ����ȼ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���Ȼ�ѧ����ʽ�л�ѧ��������ʾ���Ӹ��� |
| B���÷�Ӧ�Ħ�H2��+483��6 kJ/mol |
| C��|��H2|<|��H1| |
| D��|��H2|>|��H1| |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������һ�����Ļ�ѧ�� |
| B�����Ӽ��ȿ��Դ����ڻ������ֿ��Դ����ڵ����� |
| C�����ۼ��ȿ��Դ����ڻ������ֿ��Դ����ڵ����� |
| D�������߶�˹����һ�����ڻ�ѧ��ǿ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com