
下列实验中根据现象得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向NaAlO2溶液中持续通入气体Y | 先出现白色沉淀,最终沉淀又溶解 | Y可能是CO2气体 |
B | 向某溶液中加入Cu 和浓H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有NO3- |
C | 将打磨过的Al片投到一定浓度的CuCl2溶液中 | 出现气泡井有固体生成,过滤,向固体中加入过量的氨水,固体部分溶解 | Al与CuCl2溶液反应,有H2和Cu(OH)2生成 |
D | 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
科目:高中化学 来源:2017届江西省、宜春一中高三7月联考化学试卷(解析版) 题型:填空题
(8分)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是____________、_______________ 。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是___________。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过_____________mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到_____克固体。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三7月暑期阶段性测试化学试卷(解析版) 题型:填空题
(12分)以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2-2.9 | 2.8-3.1 | 22-28 | 60-65 | 1-2 | <1 |
以下是一种废钒催化剂回收工艺路线:
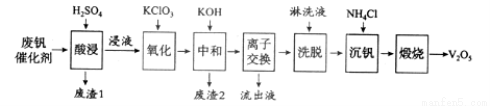
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124?形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124? R4V4O12+4OH?(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
R4V4O12+4OH?(ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”、“碱”或“中”)。
(5)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三7月暑期阶段性测试化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值。下列说法正确的是
A.2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8NA
B.标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
D.0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三入学考试理综化学试卷(解析版) 题型:实验题
(15分)某探究小组以硫酸和铜为原料设计如下四种制备硫酸铜晶体的路线:

请回答下列有关问题:
(1)甲方案中第一步发生反应的化学方程式为___________________。
(2)甲、乙、丙方案中,_____方案更合理,原因是________________。
(3)采用乙方案,用废铜、废酸(含HNO3、H2SO4)为主要原料制备硫酸铜晶体,某含有c(HNO3)=2mol•L-1,c(H2SO4)=4mol•L-1的废酸混合液100mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4 •5H2O)的质量为___________。
(4)丙方案中灼烧时,应在________中进行(填仪器名称),该实验中的后续操作指的是____________。
(5)丁方案中X可以是试剂,也可以是反应条件:
①若X为试剂,该反应的化学方程式为__________________。
②若X为反应条件,即通电,在虚线框中画出该实验设计图。

查看答案和解析>>
科目:高中化学 来源:2017届湖南衡阳八中高三实验班暑期第一次月考理综化学(解析版) 题型:实验题
(本题满分18分)草酸亚铁为黄色固体,作为一种化工原料,可广泛用于涂料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:
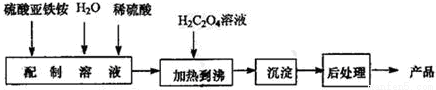
(1)配制(NH4)2Fe(SO4)2 6H2O溶液时,需加入少量稀硫酸,目的是_____________。
6H2O溶液时,需加入少量稀硫酸,目的是_____________。
(2)得到的草酸亚铁沉淀需充分洗涤,检验是否洗涤干净的方法是_____________。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
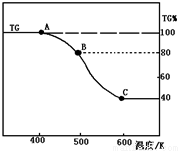
①则A-B发生反应的化学方程式为_____________;
②已知B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式_____________;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1 mL。
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+,过滤。
Ⅳ.洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液。
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V2 mL。
回答下列问题:
①已知:草酸(H2C2O4)与酸性高锰酸钾溶液反应,现象是有气泡产生,紫色消失,写出该反应的离子方程式:_____________;
②若省略步骤Ⅳ,则测定的草酸根离子含量 (填“偏大”、“偏小”或“不变”)。
③m g样品中草酸根离子的物质的量为_____________(用c,V1,V2的式子表示,不必化简)
查看答案和解析>>
科目:高中化学 来源:2017届湖南衡阳八中高三实验班暑期第一次月考理综化学(解析版) 题型:选择题
下列各组离子一定能大量共存的是
A.某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42-
B.能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32-
C.加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl-
D.常温下pH=12的溶液: K+、Ba2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是( )
A.将铜插入稀硝酸中:Cu+4H++2NO3﹣═Cu2++2NO2↑+H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe═2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+3H+═H2SiO3↓+3Na+
查看答案和解析>>
科目:高中化学 来源:2017届湖南长沙一中高二上第一次月考(开学考试)化学卷(解析版) 题型:填空题
碳酸:H2CO3,K1=4.3×10-7,K2=5.6×10-11、草酸:H2C2O4,K1=5.9×10-2,K2=6.4×10-5
0.1mol/L Na2CO3溶液的pH________0.1mol/L Na2C2O4溶液的pH;(选填“大于”“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是________;若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是________(选填编号);
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
d.[H2CO3]>[HCO3-]>[HC2O4-]>[CO32-]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com