

| 名称 | 相对分 子质量 | 性状 | 密度(g/mL) | 沸点(℃) | 溶解性 | |
| 苯胺 | 93 | 无色油状液体 | 1.02 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,可溶于热水 | 易溶于乙醇、乙醚 |

分析 (1)苯胺不稳定,容易被空气中的氧气氧化为硝基苯,为防止苯胺在反应过程中被氧化,需要加入还原剂Zn粉;
(2)水的沸点是100℃,加热至105℃左右,就可以不断分出反应过程中生成的水,促进反应正向进行;
(3)若看到温度计温度下降或锥形瓶内液体不再增加就表面反应物的蒸气较少,生成物达到了最大量,反应基本完成;
(4)由于步聚1加热的温度在105℃左右,而沸腾的水温度为100℃,不能达到该温度,所以步骤1可用油浴加热的方法;
(5)由于乙酰苯胺微溶于冷水,溶于热水,所以洗涤粗品最合适的试剂是用少量冷水洗,以减少因洗涤造成的损耗;
(6)避免过滤过程中损失,趁热过滤;
(7)计算苯胺、乙酸的物质的量,判断反应物过量问题,根据不足量的物质计算乙酰苯胺的理论产量,进而计算乙酰苯胺的产率.
解答 解:(1)由于苯胺不稳定,容易被空气中的氧气氧化为硝基苯,加入还原剂Zn粉,可以防止苯胺在反应过程中被氧化,
故答案为:防止苯胺在反应过程中被氧化;
(2)水的沸点是100℃,加热至105℃左右,就可以不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率,
故答案为:不断分出反应过程中生成的水,促进反应正向进行,提高生成物的产率;
(3)若看到温度计温度下降或锥形瓶内液体不再增加就表面反应物的蒸气较少,生成物达到了最大量,反应基本完成,
故答案为:温度计温度下降或锥形瓶内液体不再增加;
(4)由于步聚1加热的温度在105℃左右,而沸腾的水温度为100℃,不能达到该温度,所以步骤1可用油浴加热的方法;
故答案为:油浴;
(5)由于乙酰苯胺微溶于冷水,溶于热水,易溶于乙醇、乙醚,所以洗涤粗品最合适的试剂是用少量冷水洗,以减少因洗涤造成的损耗,
故答案为:A;
(6)步骤2得到的粗晶体中因含有某些杂质而颜色较深,步骤3重结晶的操作是:将粗晶体用热水溶解,加入活性炭0.1g,煮沸进行脱色,趁热过滤减少晶体的损耗,再将滤液冷却结晶;
故答案为:趁热过滤;
(7)n(苯胺)=$\frac{9.3mL×1.02g/mL}{93g/mol}$=0.102mol,n(乙酸)=( 18.4mL×1.05g/ml)÷60g/mol=0.322mol,二者按1:1反应,由于乙酸的物质的量大于苯胺的物质的量,所以产生乙酰苯胺的物质的量要以不足量的苯胺为原料为标准,乙酰苯胺的理论产量为0.102mol,而实际产量n(乙酰苯胺)=9.1g÷135g/mol=0.067mol,所以乙酰苯胺的产率为(0.06mol÷0.1mol)$\frac{0.067mol}{0.102mol}$×100%=65.7%,
故答案为:65.7%.
点评 本题考查有机物的合成实验、基本操作、实验条件的控制与分析评价等,为高频考点,侧重考查学生的分析、实验和计算能力,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:填空题
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
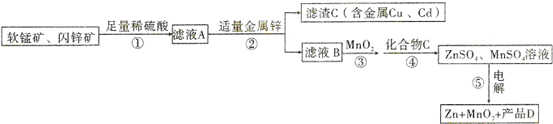
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
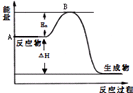 2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:
2SO2(g)+O2(g)?2SO3(g)△H=a kJ•mol-1,反应过程的能量变化如图所示.已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
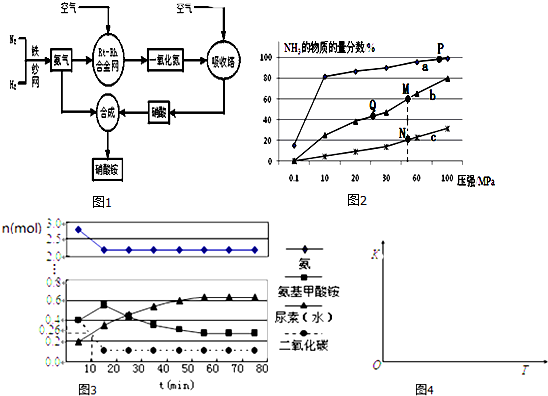
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将待测液NaOH溶液取到锥形瓶后,露置空气中较长时间,以酚酞为指示剂测定 | |
| B. | 以甲基橙为指示剂,当甲基橙变红时停止滴定 | |
| C. | 移液管用蒸馏水冲洗后直接移取待测液 | |
| D. | 滴定终点读数时俯视 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
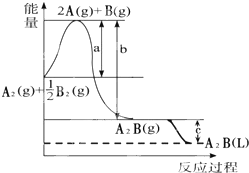 已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:
已知:A2(g)+$\frac{1}{2}$B2(g)═A2B(g),反应过程中能量变化如图,问:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com