
【题目】对于难溶盐MX,其饱和溶液中M+和X-浓度之间的关系为Ksp=c(M+)c(X-),现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是( )
①20mL0.01molL-1KCl溶液;②30mL0.02molL-1CaCl2溶液;③40mL0.03molL-1HCl溶液;④10mL蒸馏水;⑤50mL0.05molL-1AgNO3溶液
A.①>②>③>④>⑤B.④>①>③>②>⑤
C.⑤>④>②>①>③D.④>③>⑤>②>①
【答案】B
【解析】
AgCl(s)![]() Ag++Cl-,由于c(Ag+)·c(Cl-)=Ksp,c(Cl-)或c(Ag+)越大,越能抑制AgCl的溶解,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。①中c(Cl-)=0.01 mol·L-1 ②中c(Cl-)=0.04 mol·L-1 ③中c(Cl-)=0.03 mol·L-1 ④中c(Cl-)=0 mol·L-1 ⑤中c(Ag+)=0.05 mol·L-1,
Ag++Cl-,由于c(Ag+)·c(Cl-)=Ksp,c(Cl-)或c(Ag+)越大,越能抑制AgCl的溶解,AgCl的溶解度就越小。注意AgCl的溶解度大小只与溶液中Ag+或Cl-的浓度有关,而与溶液体积无关。①中c(Cl-)=0.01 mol·L-1 ②中c(Cl-)=0.04 mol·L-1 ③中c(Cl-)=0.03 mol·L-1 ④中c(Cl-)=0 mol·L-1 ⑤中c(Ag+)=0.05 mol·L-1,
Ag+或Cl-浓度由小到大的顺序为④<①<③<②<⑤,故AgCl的溶解度由大到小的排列顺序为④>①>③>②>⑤。
答案选B。


科目:高中化学 来源: 题型:
【题目】在密闭容器中充入4 mol A,在一定温度和体积可变的密闭容器中发生如下反应:4A(g) ![]() 3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
3B(g)+C(g);ΔH<0,达到平衡时有30%的A发生反应,下列判断正确的是
A. 若向密闭体系内再加入3molB、2molC,达平衡时C的百分含量与原平衡相同
B. 达到平衡时气体的总物质的量、密度都不发生变化
C. 反应达平衡的过程中,释放出的热量不发生变化
D. 升高温度A的转化率大于30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应 Cu(s)+2Ag+(aq) == Cu2+(aq)+2Ag(s)设计成如图所示原电池。下列说法中正确的是( )
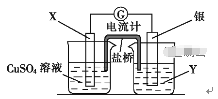
A. 电极X是正极,其电极反应为Cu-2e-== Cu2+
B. 银电极板质量逐渐减小,Y溶液中c(Ag+)增大
C. 当X电极质量变化0.64 g时,Y溶液质量变化2.16 g
D. 外电路中电流由银极流向铜极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:

下列说法正确的是( )
A.该反应的△H>0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用高温高压的条件,目的都是提高原料气的转化率
D.t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
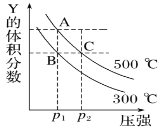
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是![]()
A.![]()
![]() 的
的![]() 溶液:
溶液:![]() 、
、![]() 、
、![]() 、
、![]()
B.甲基橙呈红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
C.![]() 的溶液:
的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
D.使KSCN显血红色的溶液:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是极硬的银白色金属,主要用于冶炼各种合金钢和电镀。已知铬在自然界最重要的矿物是铬铁矿![]() 或
或![]() ,工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程。
,工业上制备较纯的金属铬的方法常用铝热法,其中一种简要流程。

![]() 如果在实验室模拟操作
如果在实验室模拟操作![]() ,应包括过滤和洗涤。实验室洗涤沉淀的操作是______。
,应包括过滤和洗涤。实验室洗涤沉淀的操作是______。
![]() 完成流程图中铬铁矿焙烧时的化学反应方程式______。
完成流程图中铬铁矿焙烧时的化学反应方程式______。
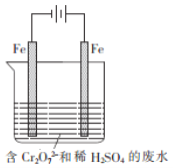
![]() 重铬酸钾为橙红色晶体,广泛用于鞣革、电镀、有机合成等领域。鞣革过程中,生皮中蛋白质发生了______而变得经久耐用。工业科用电解法来处理含
重铬酸钾为橙红色晶体,广泛用于鞣革、电镀、有机合成等领域。鞣革过程中,生皮中蛋白质发生了______而变得经久耐用。工业科用电解法来处理含![]() 废水,实验室利用如图装置模拟该法。电解过程中溶液里发生反应:
废水,实验室利用如图装置模拟该法。电解过程中溶液里发生反应:![]() 若某一时间段内溶液中减少了
若某一时间段内溶液中减少了![]() ,则这段时间电路中至少转移了______mol电子
,则这段时间电路中至少转移了______mol电子
![]() 已知:
已知:
![]() 时
时![]() 溶液中仅存在两种含铬离子
溶液中仅存在两种含铬离子![]() 、
、![]() ,在溶液中存在:
,在溶液中存在:
![]() 黄色
黄色![]() 橙色
橙色![]()
![]()
![]() 时,
时,![]() 易溶于水,
易溶于水,![]() 难溶于水,且
难溶于水,且![]()
Ⅰ![]() 第
第![]() 步反应的下列状态一定达到平衡的是______
步反应的下列状态一定达到平衡的是______
![]() 和
和![]() 的浓度相同
的浓度相同
![]()
![]() 溶液的颜色保持不变
溶液的颜色保持不变
Ⅱ![]() 若将
若将![]() 的
的![]() 溶液和一定浓度的硝酸等体积混合,充分混合后溶液的
溶液和一定浓度的硝酸等体积混合,充分混合后溶液的![]() ,则此时溶液中两种含铬离子浓度之比
,则此时溶液中两种含铬离子浓度之比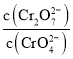 的近似值______,取此混合液1ml与
的近似值______,取此混合液1ml与![]() 的
的![]() 溶液混合,试判断混合溶液______
溶液混合,试判断混合溶液______![]() 填“能”或“不能”
填“能”或“不能”![]() 生成沉淀。
生成沉淀。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题
(1)KHSO4溶液的pH______(填“>”“<”或“=”)7,用离子方程式表示为___________。
(2)KHCO3溶液的pH_____(填“>”“<”或“=”)7,用离子方程式表示为____________。
(3)将上述两种溶液混合,现象是_______________,用离子方程式表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:
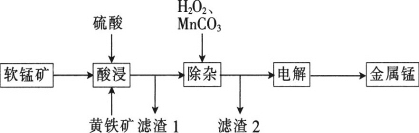
已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:____________________________。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是_______________(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为____________________,电解后阳极的电解质溶液可返回_______________________(填“酸浸”“除杂”或“电解”)工序继续使用。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com