24gSO32-恰好将1.204×1023个XO4-离子还原,则x元素在还原产物中的化合价是( )
A.+1
B.+2
C.+3
D.+4
【答案】
分析:SO
32-将XO
4-离子还原,则SO
32-被氧化为SO
42-,XO
4-离子中x元素的化合价为+7,令x元素在还原产物中的化合价为a,根据电子转移守恒列方程计算a值.
解答:解:24gSO
32-的物质的量为
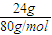
=0.3mol,1.204×10
23个XO
4-离子的物质的量为0.2mol.
SO
32-将XO
4-离子还原,则SO
32-被氧化为SO
42-,S元素化合价由+4价升高为+6价,XO
4-离子中x元素的化合价为+7,令x元素在还原产物中的化合价为a,根据电子转移守恒,则:
0.3mol×(6-4)=0.2mol×(7-a)
解得:a=+4.
故选D.
点评:本题考查氧化还原反应计算,难度中等,判断SO
32-被氧化为SO
42-是解题关键,注意守恒思想在氧化还原反应计算中的应用.

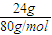 =0.3mol,1.204×1023个XO4-离子的物质的量为0.2mol.
=0.3mol,1.204×1023个XO4-离子的物质的量为0.2mol.
