
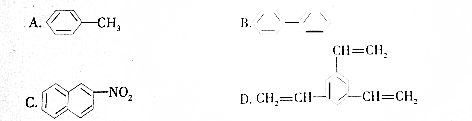
| A. | A | B. | B | C. | C | D. | D |
分析 苯环上的一氯代物有3种,说明苯环上有三种化学环境不同的H原子,结合1mol该化合物催化加氢时最多消耗6mol H2,则分子中含有2个苯环,含有1个苯环、3个碳碳双键等,以此解答该题.
解答 解:苯环上的一氯代物有3种,说明苯环上有三种化学环境不同的H原子,1mol该化合物催化加氢时最多消耗6mol H2,则烃的不饱和度为6,
A.C6H5-CH3 苯环上有3种H原子,1mol该有机物能最多与3mol氢气发生加成反应,不符合题意,故A错误;
B.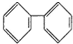 是对称结构,苯环上有3种H原子,1mol有机物
是对称结构,苯环上有3种H原子,1mol有机物 最多与6mol氢气发生加成反应,符合题意,故B正确;
最多与6mol氢气发生加成反应,符合题意,故B正确;
C.一氯代物有7种,故C错误;
D.1mol有机物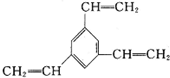 最多与6mol氢气发生加成反应,但苯环上有1种H原子,不符合题意,故D错误,
最多与6mol氢气发生加成反应,但苯环上有1种H原子,不符合题意,故D错误,
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,难度不大,注意把握有机物结构的对称性的判断.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:选择题
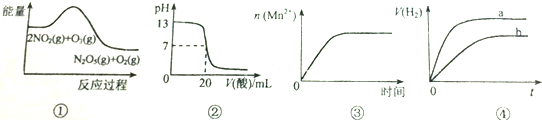
| A. | ①表示化学反应2NO2(g)+O3(g)═N2O5(g)+O2(g)△H>0 | |
| B. | ②表示25℃时,用0.5mol/LCH3COOH溶液滴定20mlNaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | ③表示10ml 0.01mol/L KMnO4 酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | ④表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清石灰水与稀硝酸反应 | B. | 硫在氧气中燃烧 | ||
| C. | 钠粒与稀盐酸反应 | D. | 碳酸氢钠溶液与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
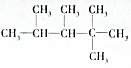 的烷烃,则此烯烃可能的结构简式是CH2=CHCH3CHCH3C(CH3)3、(CH3)2C=CCH3C(CH3)3、(CH3)2CHC=CH2C(CH3)3.
的烷烃,则此烯烃可能的结构简式是CH2=CHCH3CHCH3C(CH3)3、(CH3)2C=CCH3C(CH3)3、(CH3)2CHC=CH2C(CH3)3.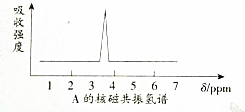
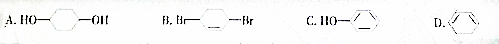
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净酸式滴定管后,立即装入标准盐酸进行滴定 | |
| B. | 锥形瓶用待测NaOH溶液润洗后,再装入NaOH 溶液进行滴定 | |
| C. | 操作过程中,滴定前平视读数,滴定后仰视读数 | |
| D. | 用酚酞作指示剂滴至红色刚退去,停止滴沄,立即读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
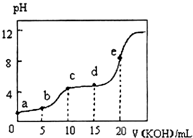 常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )
常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )| A. | a点所示溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$<1012 | |
| B. | c点所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | e点所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) | |
| D. | 五个点中d点时c(HR-)最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
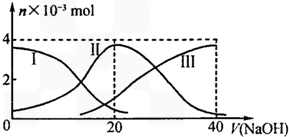 25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| B. | 向Na2A溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 欲使NaHA溶液呈中性,可以向其中加入酸 | |
| D. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:[Na+]>[HA-]>[H+]>[A2-]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{n}$ mol-1 | B. | 9n mol-1 | C. | 2nmol-1 | D. | 18nmol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com