
| A. | 酸性:HClO4>HBrO4>HIO4 碱性:NaOH>KOH>RbOH | |
| B. | 原子半径:Na>O>F 离子半径:Na+>O2->F- | |
| C. | 稳定性:HF>H2O>H2S 还原性:HCl<H2S<PH3 | |
| D. | 还原性:Na>Mg>Al 氧化性:P>S>Cl2 |
分析 A.元素的非金属、金属性越强,对应的最高价氧化物的水化物的酸性、碱性越强;
B.同周期元素从左到右元素的原子半径逐渐减小,核外电子排布相同的离子,核电荷数越大离子半径越小;
C.元素的非金属性越强,对应的氢化物越稳定,氢化物的还原性越弱;
D.元素的非金属性越强,对应的氧化性越强,金属性越强,单质的还原性越弱.
解答 解:A.金属性Rb>K>Na,金属性越强,对应的最高价氧化物的水化物的越强,故A错误;
B.核外电子排布相同的离子,核电荷数越大离子半径越小,应为O2->F->Na+,故B错误;
C.非金属性F>O>S,Cl>S>P,元素的非金属性越强,对应的氢化物越稳定,氢化物的还原性越弱,故C正确;
D.非金属性Cl>S>P,元素的非金属性越强,对应的氧化性越强,故D错误.
故选C.
点评 本题考查元素的性质,为高频考点,把握同主族、同周期元素的性质比较规律为解答的关键,注意元素周期律的应用和规律性知识的归纳,题目难度不大.


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Ca(ClO)2、KAl(SO4)2﹒12H2O | B. | Cl2、KAl(SO4)2﹒12H2O | ||
| C. | H2O、SO2 | D. | H2SO4、亚硫酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它位于元素周期表的第六周期第ⅥA族 | |
| B. | 它可能是非金属元素 | |
| C. | 它能与氢气化合生成稳定的气态氢化物 | |
| D. | 它的中子数比质子数大51 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.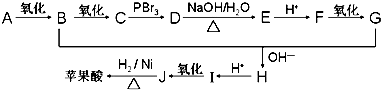


 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30g乙烷含有的共价键数目为8NA | |
| B. | 标况下,22.4L己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA | |
| C. | 1mol甲基含10 NA个电子 | |
| D. | 2.8g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的摩尔质量是64g | |
| B. | 常温常压下,64gSO2中所含的分子数约为6.02×1023个 | |
| C. | 1molSO2的质量是64g/mol | |
| D. | 常温常压下,1molSO2的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com