
【题目】电解法处理CO2和SO2的混合气体的原理如图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是( )
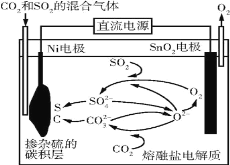
A.Ni电极表面发生了还原反应
B.阳极的电极反应为2O2--4e-=O2↑
C.电解质中发生的离子反应只有2SO2+O2+2O2-=2SO![]()
D.该过程实现了电解质中熔融碳酸盐和硫酸盐的自主补充循环
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种广谱、高效的杀菌消毒剂,有与氯气相似的强烈刺激性气味,易溶于水,沸点11℃,遇热不稳定易分解发生爆炸。一种工业制法用硫铁矿(主要成分为FeS2)还原氯酸钠制取二氧化氯,某研究小组在实验室设计如下装置制备ClO2的水溶液。
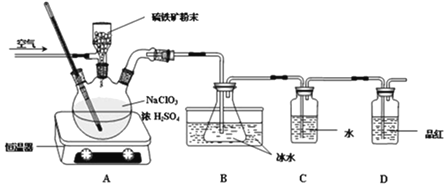
(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。反应开始时烧瓶内发生反应的离子方程式如下,请配平该方程式:__ClO3- +__FeS2+__H+=____ClO2+____Fe3++____SO42-+____H2O
(2)装置D的作用是__________。
(3)用上述反应完后的废液(除上述产物外,还有Al3+、Mg2+、H+、Cl-等)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下:

回答下列问题:
①操作Ⅰ的名称为:___________。
②试剂X是___________,写出发生的主要反应的离子方程式__________。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/L KMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4_被还原成Mn2+。测得消耗KMnO4溶液的平均体积为21.00mL。则该晶体中铁的质量分数为___________。(保留4位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物转化题。A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。根据题意回答下列问题:
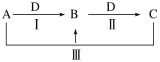
(1)若A、B、C的焰色反应均为黄色,C为厨房中的用品,D的过度排放会造成温室效应。
①A的化学式______________,B的俗名____________;
②反应Ⅱ的离子方程式是_____________。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅱ的离子方程式是____________;
②反应Ⅲ的离子方程式表示反应__________;
③检验B中阳离子最好的试剂是_________(写化学式)。
(3)C与NaOH溶液反应,用离子方程式表示产生此现象的过程________、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成的重要中间体F的一种合成路线如下:
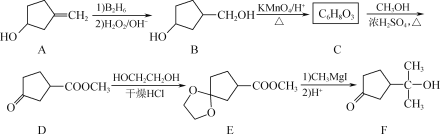
(1) F中含氧官能团的名称是________、________。
(2) C的结构简式为________。
(3) 从整个流程看,D→E的作用是___________。
(4) G为比E相对分子质量大14的同系物,H与G互为同分异构体且符合下列条件:
① 1 mol H能与2 mol NaHCO3反应;
② H能使溴的四氯化碳溶液褪色;
③ H分子中含有3种不同化学环境的氢。
则H的结构简式为________(写一种)。
(5) 写出以![]() 、CH3OH和CH3CH2MgI为主要原料制备
、CH3OH和CH3CH2MgI为主要原料制备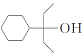 的合成路线____________ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线____________ (无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL含有1mol/L的氯化铝和一定量盐酸的溶液中逐滴加入浓度为1mol/L的氢氧化钠溶液,产生沉淀的质量与所加碱的体积如图所示:
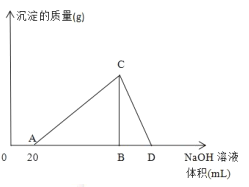
(1)写出AC段和CD段发生反应的离子方程式:
AC_______________________________________
CD_______________________________________
(2)盐酸溶液的浓度是____________________。
(3)若产生0.78g白色沉淀,则加入的氢氧化钠溶液的体积可能是__________________。
(4)D点表示的氢氧化钠溶液的体积是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银由于其优良的性能和特性被广泛应用于照相、电子、电气等工业。废定影液中银主要以Na3Ag(S2O3)2形式存在,实验室用废定影液制备Ag的具体流程如图所示:
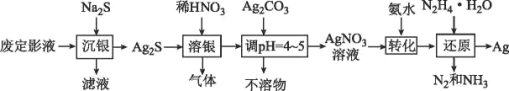
注意:“还原”时由于Ag+直接与N2H4H2O反应过于激烈,所以采用加入氨水,使Ag+与氨形成[Ag(NH3)2]+,降低Ag+的浓度,从而相应降低Ag+的氧化能力,使反应能够平稳进行。
回答下列问题:
(1)“溶银”时产生的气体是__(填物质的名称),得到1mol该气体转移电子为__mol。
(2)N2H4H2O(水合肼)为无色透明的油状发烟液体,具有强还原性,实验室制备原理为NaClO+2NH3=N2H4H2O+NaCl,可能用到的实验装置如图所示:
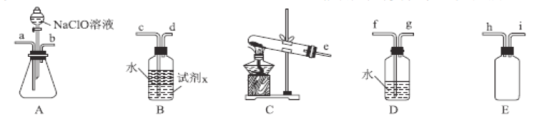
①本实验中用不到的装置是__(填字母),按气流从左到右的方向,整套装置的连接顺序为__(填仪器接口小写字母)。
②从氧化还原角度分析,上述反应中NaClO表现出的性质为__;加入NaClO溶液时要慢慢滴加,目的是__。
(3)AgNO3见光或受热易分解。将上述流程中AgNO3溶液蒸发浓缩可获得AgNO3固体,实验装置如图所示:

①使用真空泵的目的是__。
②测定AgNO3固体的纯度(杂质不参与反应)称取2.000g制备的AgNO3固体,加水溶解,定容到100mL;准确量取25.00mL溶液,酸化后滴入几滴NH4Fe(SO4)2溶液作指示剂,再用0.1000molL-1NH4SCN标准溶液滴定,消耗NH4SCN标准溶液的平均体积为29.00mL,则固体中AgNO3的质量分数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在含有生命元素硒(![]() )的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
)的保健品已经进入市场,已知硒与氧同族,与钾同周期,则下列关于硒的叙述中正确的是( )
A.硒单质在常温下是固体
B.硒的气态氢化物稳定性比![]() 强
强
C.硒是金属元素
D.硒酸(![]() )的酸性比硫酸强
)的酸性比硫酸强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 将NaHCO3溶液滴入Ca(ClO)2溶液中 | 出现沉淀 | Ka2(H2CO3)> Ka (HClO) |
B | 将湿润的KI-淀粉试纸置于集满红棕色气体的集气瓶口 | 试纸变蓝 | 该气体为Br2 |
C | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液 | 出现沉淀 | 沉淀只有AgBr |
D | 将石蜡油蒸汽通过炽热的碎瓷片,再将生成的气体通入溴的CCl4溶液中 | 溶液褪色 | 石蜡油催化裂解生成不饱和烃 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Na2S溶液与KMnO4溶液反应,实验过程如下:
实验序号 | Ⅰ | Ⅱ |
实验过程 | 滴加6滴(约0.3mL)0.01mol/LNa2S溶液
| 滴加6滴(约0.3mL)0.01mol/L酸性KMnO4溶液(H2SO4酸化至pH=0)
|
实验现象 | 紫色变浅(pH<1),生成棕褐色沉淀(MnO2) | 溶液呈淡黄色(pH≈8),生成浅粉色沉淀(MnS) |
资料:ⅰ.![]() 在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
在强酸性条件下被还原为Mn2+,在近中性条件下被还原为MnO2。
ⅱ.单质硫可溶于硫化钠溶液,溶液呈淡黄色。
下列说法不正确的是( )。
A.根据实验可知,Na2S被氧化
B.取少量实验Ⅰ所得溶液进行实验,检测到有![]() ,不能说明S2-被
,不能说明S2-被![]() 氧化为
氧化为![]()
C.实验Ⅰ中生成棕褐色沉淀,说明酸性条件下S2-能将![]() 还原为MnO2
还原为MnO2
D.实验Ⅱ得到浅粉色沉淀,是由于S2-将新生成的![]() 还原为Mn2+并迅速与其结合所致
还原为Mn2+并迅速与其结合所致
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com