
【题目】根据碘与氢气反应的热化学方程式下列判断正确的是

A.254g I2(g)中通入2g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
【答案】D
【解析】
试题分析:已知:①I2(g)+H2(g)2HI(g)△H=-9.48kJmol-1;②I2(s)+H2(g)2HI(g)△H=+26.48kJmol-1,利用盖斯定律将①-②可得I2(g)=I2(s)△H=-9.48kJmol-1-26.48kJmol-1=-35.96kJmol-1。A.n(I2)=1moL,n(H2)=1mol,由于该反应为可逆反应,则放出的热量小于9.48kJ,故A错误;B.由I2(g)=I2(s)△H=-35.96kJmol-1,可知1mol固态碘与1mol气态碘所含的能量相差35.96kJ,故B错误;C.反应①、②的产物都是HI,状态相同,稳定性相同,故C错误;D.由I2(g)=I2(s)△H=-35.96kJmol-1,可知I2(g)能量大于I2(s),故D正确;故选D。


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
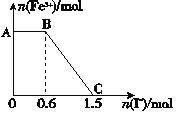
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.15 mol
D.K2Cr2O7与FeSO4反应的物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) ![]() I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
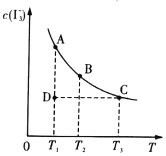
A.I2(aq)+I-(aq) ![]() I3-(aq)的△H>0
I3-(aq)的△H>0
B.若温度T1,T2的平衡常数分别为K1,K2,则K1>K2
C.反应进行到状态D时,一定有V正>V逆
D.状态A与状态B相比,状态A的c(I2)大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于微量元素和大量元素的说法,正确的是( )
A. 都属于生命活动的必需元素
B. 都属于生命活动的主要元素
C. 前者是细胞特有的,后者是细胞与非生物界共有的
D. 两者都是细胞自身合成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于铅蓄电池Pb+PbO2+2H2SO4![]() PbSO4+2H2O的说法正确的是
PbSO4+2H2O的说法正确的是
A.在放电时,正极发生的反应是Pb(s)+SO42—(aq)=PbSO4(s)+2e—
B.在放电时,该电池的负极材料是铅板
C.在充电时,电池中硫酸的浓度不断变小
D.在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,红棕色的NO2可以发生如下反应:2NO2(g)![]() 2NO(g)+O2(g)△H>0,下列叙述中正确的是
2NO(g)+O2(g)△H>0,下列叙述中正确的是
A. 恒温恒容,充入NO2气体,其转化率增大
B. 加压,平衡向逆反应方向移动,混合气体颜色变深
C. 若平衡常数增大,则可能是升高了温度或减小了体系的压强
D. 当2v正(NO)=v逆(O2)时,反应达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为VL的硫酸铝溶液中加入足量的氨水,过滤得沉淀,将沉淀洗净后灼烧至质量不再变化时冷却、称量,得mg白色固体。原溶液中c (SO42-)为( )
A.![]() mol·L-l B.
mol·L-l B.![]() mol·L-l C.
mol·L-l C.![]() mol·L-l D.
mol·L-l D.![]() mol·L-l
mol·L-l
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com