
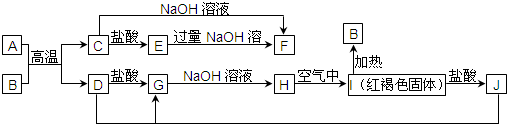
 已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.
已知A是一种常见金属,F是一种红褐色沉淀.试根据图中转化关系,回答下列问题.

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、7.8g苯中含有0.3NA个碳碳双键,0.3NA个碳碳单键 |
| B、2L 0.1 mol/L的醋酸钠溶液中,醋酸根离子数为0.2NA |
| C、5.6g铁与足量的稀硝酸反应,失去电子数为0.2NA |
| D、SiO2晶体中,有NA个Si就有4NA个Si-O键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、贝采利乌斯 | B、维勒 |
| C、李比希 | D、海维西 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液.下列说法不正确的是( )
如图为CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液.下列说法不正确的是( )| A、工作时,铜片作阴极 |
| B、工作时,K+向铜片电极移动 |
| C、工作时,铂片上的电极反应式为4OH--4e-=O2↑+2H2O |
| D、若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com