
分析 当O2、Cl2、O3通入KI溶液时,发生下列反应:①Cl2+2KI═2KCl+I2,②O3+2KI+H2O═2KOH+I2+O2,由②式知该反应前后气体体积没变化,故引起体积变化的是①式的Cl2参与了反应,故Cl2的体积为1L-0.98L=0.02L,所以φ(Cl2)=$\frac{0.02L}{1L}$×100%=2%,
设O3的物质的量为xmol,则②式生成I2为xmol,①式生成I2为$\frac{0.02L}{22.4L/mol}$,由I2-2Na2S2O3关系,则有关系式:xmol+$\frac{0.02L}{22.4L/mol}$=$\frac{0.1mol/L×0.0267L}{2}$,解得x=4.42×10-4 mol,故O3的体积分数为$\frac{4.42×1{0}^{-4}mol×22.4L/mol}{1L}$×100%=1%,据此进行分析.
解答 解:当O2、Cl2、O3通入KI溶液时,发生下列反应:①Cl2+2KI═2KCl+I2,②O3+2KI+H2O═2KOH+I2+O2,由②式知该反应前后气体体积没变化,故引起体积变化的是①式的Cl2参与了反应,故Cl2的体积为1L-0.98L=0.02L,所以φ(Cl2)=$\frac{0.02L}{1L}$×100%=2%,
设O3的物质的量为xmol,则②式生成I2为xmol,①式生成I2为$\frac{0.02L}{22.4L/mol}$,由I2-2Na2S2O3关系,则有关系式:xmol+$\frac{0.02L}{22.4L/mol}$=$\frac{0.1mol/L×0.0267L}{2}$,解得x=4.42×10-4 mol,故O3的体积分数为$\frac{4.42×1{0}^{-4}mol×22.4L/mol}{1L}$×100%=1%.
答:气态反应产物中Cl2与O3的体积分数各是2%、1%.
点评 正确书写方程式是本题解题的关键,注意利用方程式确定物质之间的关系,本题题目难度中中等.


科目:高中化学 来源: 题型:选择题
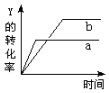 反应 2X(g)+3Y(g)?Z(g)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间的关系如图所示.若使曲线a变为曲线b,可采取( )
反应 2X(g)+3Y(g)?Z(g)+Q(Q>0),在一定条件下,反应物Y的转化率与反应时间的关系如图所示.若使曲线a变为曲线b,可采取( )| A. | 降低温度 | B. | 减小压强 | C. | 加入催化剂 | D. | 增大Y的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
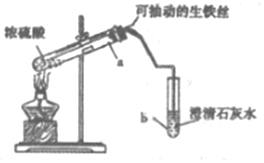 某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.
某实验小组同学设计了如图装置,探究生铁与少置浓硫酸反应生成的气体产物.| A | B | C | D | E |
 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
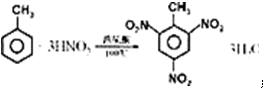 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气质量日报中CO2含量属于空气污染指数 | |
| B. | 日常生活中和医院常用无水乙醇杀菌消毒 | |
| C. | 绿色食品是指不含任何化学物质的食品 | |
| D. | 目前加碘食盐中主要添加的是KIO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
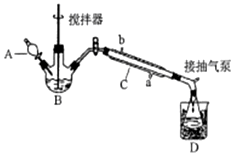 过氧乙酸(
过氧乙酸( 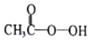 )是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:
)是一种常见消毒剂,具强氧化性,减压蒸馏法制备过氧乙酸的步骤及装置如图:| 反应物比例 CH3COOH/H2O2 | 反应时间(小时) | ||||
| 0.5 | 1 | 3 | 5 | 7 | |
| 2:1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
| 1:1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
| 1:2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com