
下列反应的离子方程式正确的是
A.用氨水吸收过量的二氧化硫:NH3·H2O+SO2=NH4++HSO3-
B.在澄清石灰水中通入少量二氧化碳:OH-+CO2=HCO3-
C.向溴化亚铁中通入少量氯气:2Br-+Cl2=2Cl-+Br2
D.用氢氧化钠吸收多余的氯气:OH-+Cl2=2Cl-+HClO
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2015届安徽省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列叙说正确的是
A.同温同压下,若物质物质的量相等, 其体积一定相等
B.1升氮气比1升氧气的质量小
C.等体积的二氧化碳和一氧化碳所含分子数一定相等
D.相同条件下的一氧化碳和氮气,若体积相等,则质量一定相等
查看答案和解析>>
科目:高中化学 来源:2015届安徽省高三第一次联考化学试卷(解析版) 题型:填空题
(8分)A、B、C、D四种元素均为元素周期表中的短周期元素,原子序数依次增大,A元素基态原子中p电子数是s电子数的二分之一,B元素最高价氧化物的水化物与其氢化物能够反应生成一种盐,C元素与D元素能形成原子个数比为1:2和1:1的两种常见离子化合物。
(1)A、B、C三种元素的电负性从大到小的顺序是_______________(填元素符号)
(2)D元素原子核外的电子排布式是______________.
(3)B元素与D元素形成的化合物DB2的晶体类型为____________.B2中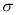 键与
键与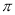 键数目之比为_________________.
键数目之比为_________________.
(4)A、C、D三种元素形成的原子个数比为A:C:D=1:2:1简单化合物的水溶液呈碱性,其原因为(用离子方程式表示):___________________________________________.
(5)已知:B2(g)+2C2(g)=2BC2(g) △H=+67.6kJ·mol-1
B2H4(g)+C2(g)=B2(g)+2H2C(g) △H=-534kJ·mol-1
请写出BC2(g)与B2H4(g)反应生成B2(g)和H2C(g) 的热化学方程式:___________________.
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:实验题
(15分)纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油扭、涂料、密封胶与胶粘剂等行业。在浓CaCl2,溶液中通人NH3和CO2,可以制得纳米级碳酸钙。某校学生实验小组设计下图所示装置,制取该产品。D中装有他稀硫酸的脱脂棉.图中夹持装置已略去。
I.可选用的药品有:a.石灰石b.饱和氯化钙溶液c.6 mol/L盐酸d.氯化铵固体e.氢氧化钙固体。
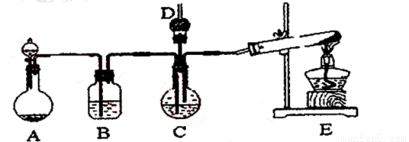
(1)A中制备气体时,所需药品是(选填字母序号)______________;
(2)B中盛有_________溶液,其作用是_____________;
(3)写出制取氨气的化学方程式_____________________;
(4)在实验过程中,向C中通入气体是有先后顺序的,应先通入的气体是_____(写化学式)
(5)检验D出口处是否有氨气逸出的方法是_______________________;
(6)写出制取纳米级碳酸钙的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
下列大小顺序排列不正确的组合是
A.气态氢化物的稳定性:HCl>HBr>HI
B.离子半径:S2->Na+>O2-
C.酸性:HClO4>H2SO4>H3PO4
D.熔点:SiO2>NaCl>干冰
查看答案和解析>>
科目:高中化学 来源:2015届安徽省皖南八校高三第一次联考化学试卷(解析版) 题型:选择题
根据下列标准,分类合理的是
A.根据物质的组成元素是否单一,将纯净物分为单质和化合物
B.根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质
C.根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
D.根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2015届安徽省江淮十校高三11月联考化学试卷(解析版) 题型:选择题
电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.100 mol·L-1 NH3·H2O滴定10 mL浓度均为0.100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。
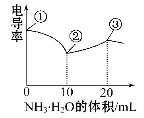
下列说法正确的是
A.①溶液中c(H+)为0.200 mol·L-1
B.溶液温度高低为①>③>②
C.③点溶液中有c(Cl—)>c(CH3COO—)
D.③点后因离子数目减少使电导率略降低
查看答案和解析>>
科目:高中化学 来源:2015届宁夏银川市高三上学期期中考试化学试卷(解析版) 题型:填空题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)
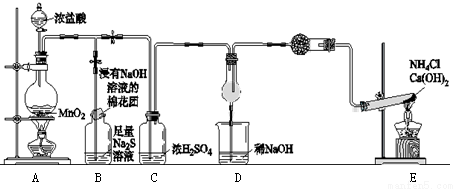
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)试从原子结构角度解释氯的氧化性大于硫原因 。
(4)D中干燥管中出现的现象及化学方程式 ; 。
(5)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,该洗气装置中盛装 试剂。
(6)还有什么方法能证明氧化性Cl2 > S,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源:2015届宁夏高三上学期期中考试理科综合化学试卷(解析版) 题型:填空题
(Ⅰ)在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)  2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下面空白。
(1)用D表示的平均反应速率为____________A的转化率为____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度____________(填“增大”、“减少”或“不变”)。
(3)若向原平衡体系再投入1 mol A和1 mol B,平衡____________(填“右移、左移或不移”)。
(4)若开始时只加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入____________mol B物质。
(Ⅱ)现有反应:CO(g)+ H2O(g)  CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
CO2(g)+ H2(g) ;△H<0,在850℃时,平衡常数K=1。
(1)850℃时,若向一容积可变的密闭容器中同时充入 1.0 mol CO、3.0molH2O、1.0mol CO2 和x molH2,则:
①当x=5.0时,上述平衡向_______(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
(2)在850℃时,若设x=5.0 mol和x=6.0mol,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a _______b(填“大于”、“小于”或“等于”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com