
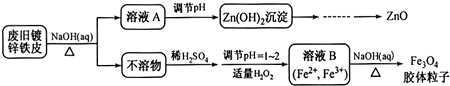
分析 废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子.
(1)已知溶液A中锌转化为锌酸钠(Na2ZnO2),是锌和氢氧化钠溶液反应生成偏锌酸钠和氢气;
(2)氢氧化锌完全沉淀依据溶度积常数计算溶液PH,调节溶液A的pH可产生Zn(OH)2沉淀,过滤就可以得到氢氧化锌沉淀,高温灼烧氢氧化锌分解得到ZnO;
(3)调节溶液pH=1-2,加适量的H2O2氧化部分亚铁离子为铁离子;
(4)Fe3O4胶体粒子能透过滤纸;
(5)重铬酸钾是强氧化剂,酸化所需酸不能具有强氧化性、不能具有还原性,根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,容量瓶用于配置溶液,胶头滴管用于加水定容;
称取ag Fe3O4样品,滴定终点消耗0.01000mol•L-1的K2Cr2O7标准溶液bmL,依据反应的离子方程式中的定量关系计算,6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O,6Fe3O4~6Fe2+~Cr2O72-,据此计算纯度.
解答 解:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子,
(1)已知溶液A中锌转化为锌酸钠(Na2ZnO2),是锌和氢氧化钠溶液反应生成偏锌酸钠和氢气,反应的化学方程式为:Zn+2NaOH=Na2ZnO2+H2↑
,故答案为:Zn+2NaOH=Na2ZnO2+H2↑;
(2)氢氧化锌完全沉淀依据溶度积常数计算溶液PH,当锌离子浓度小于10-5mol/L,沉淀完全,Ksp(Zn(OH)2)=c(Zn2+)c2(OH-)=1.0×10-17 ,c(OH-)=$\sqrt{\frac{1.0×1{0}^{-17}}{1×1{0}^{-5}}}$=10-6mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8mol/L,PH=-lg10-8=8,调节溶液A的pH可产生Zn(OH)2沉淀,过滤就可以得到氢氧化锌沉淀,洗涤除去附着的离子,高温灼烧氢氧化锌分解得到ZnO,
故答案为:8;过滤;
(3)流程分析可知调节溶液pH=1-2,加适量的H2O2氧化部分亚铁离子为铁离子得到B溶液为铁离子和亚铁离子的混合溶液,反应的离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,
故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)Fe3O4胶体粒子能透过滤纸,所以不能用过滤的方法实现固液分离,
故答案为:胶体粒子太小,过滤时容易透过滤纸;
(5)重铬酸钾是强氧化剂,酸化所需酸不能具有强氧化性、不能具有还原性,所以应选择稀硫酸,根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,容量瓶用于配置溶液,胶头滴管用于加水定容.故用不到的仪器为量筒和移液管,
故答案为:稀硫酸;③⑦;
称取ag Fe3O4样品,滴定终点消耗0.01000mol•L-1的K2Cr2O7标准溶液bmL,
6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O,
6Fe3O4~6Fe2+~Cr2O72-,
6 1
n 0.01000mol•L-1 ×b×10-3L
n=0.06b×10-3mol,
据此计算纯度=$\frac{0.06b×1{0}^{-3}mol×232g/mol}{ag}$×100%=$\frac{1.392×1{0}^{-2}b}{a}$×100%,
故答案为:$\frac{1.392×1{0}^{-2}b}{a}$×100%.
点评 本题以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查实验基本操作和技能,涉及标准溶液的配制及滴定的误差分析、对信息的利用、实验条件的控制等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
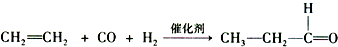
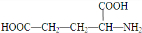 .
.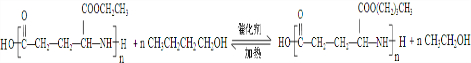 .
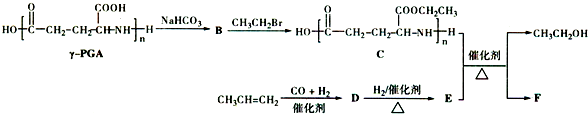
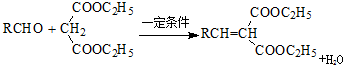
.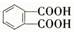 )反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式
)反应生成的产物DBP(C16H22O4)是广泛使用的增塑剂之一.DBP有多种同分异构体,其中符合下列条件的DBP的同分异构体有12种,写出其中一种同分异构体的结构简式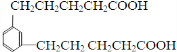 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol的CaO2含阴阳离子总数是0.3NA | |
| B. | 0.1 mol苯乙烯含π键的数目为0.4NA | |
| C. | 1 L 1mol/L的Na2CO3溶液中含阴阳离子数小于3NA | |
| D. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
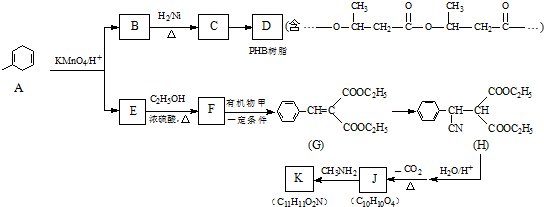
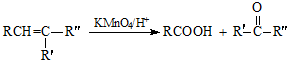
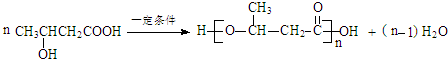 :.
:. .
.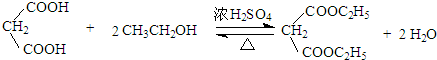 .
.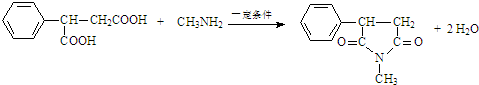 .
.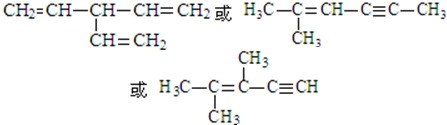 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生活中常用热的小苏打去污,利用了水解吸热的特点 | |
| B. | Mg可由电解MgCl2水溶液制取,Al可由电解熔融Al2O3制取 | |
| C. | 少数商贩在蔬菜表面洒少许福尔马林,可延长保鲜时间 | |
| D. | SiO2可用来制作光导纤维,但SiO2本身不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g•mol-1 | B. | 108g•mol-1 | C. | 55g•mol-1 | D. | 96g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
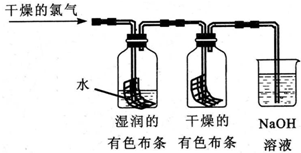
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
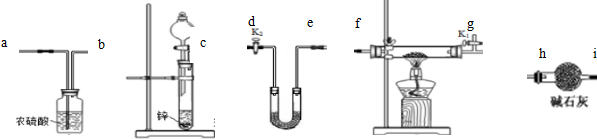
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 【化学-选修3物质结构与性质】
【化学-选修3物质结构与性质】查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com