
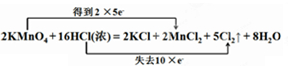
 ,生成氯化锰、氯化钾体现的是盐酸的酸性,生成氯气体现的是盐酸的还原性,化合价升高的氯元素对应产物氯气是氧化产物,化合价降低的锰元素对应的产物氯化锰是还原产物,
,生成氯化锰、氯化钾体现的是盐酸的酸性,生成氯气体现的是盐酸的还原性,化合价升高的氯元素对应产物氯气是氧化产物,化合价降低的锰元素对应的产物氯化锰是还原产物, ;AC;Cl2;MnCl2.
;AC;Cl2;MnCl2.


科目:高中化学 来源: 题型:
 25℃时,在25mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH变化如图所示,下列分析的结论中不正确的是( )
25℃时,在25mL 0.1mol/L的NaOH溶液中,逐滴加入0.2mol/L的CH3COOH溶液,溶液的pH变化如图所示,下列分析的结论中不正确的是( )| A、B点的横坐标a=12.5 |
| B、C点时溶液中有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2 c(Na+) |
| D、曲线上A、B间的任意一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、装置①制备并观察氢氧化亚铁 |
| B、装置②证明过氧化钠与水反应放热 |
| C、装置③比较KMnO4、Cl2、I2的氧化性强弱 |
| D、装置④测定盐酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有盐酸、铁、氢气、碳酸氢钠、氢氧化钡.根据要求回答下列问题:
现有盐酸、铁、氢气、碳酸氢钠、氢氧化钡.根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图).随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭.
在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如右图).随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭.查看答案和解析>>
科目:高中化学 来源: 题型:
 牙膏的成分有活性物质、摩擦剂、甘油等物质.牙膏中的摩擦剂一般由CaC03、Al(OH)3、SiO2中的一种或几种物质组成.为探究某品牌牙膏中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适量牙膏样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现沉淀减少但仍有少量不溶物.为进一步探究牙膏中摩擦剂的成分,同学们进行了以下探究:
牙膏的成分有活性物质、摩擦剂、甘油等物质.牙膏中的摩擦剂一般由CaC03、Al(OH)3、SiO2中的一种或几种物质组成.为探究某品牌牙膏中摩擦剂的成分,化学兴趣小组同学做了以下实验:取适量牙膏样品,加水充分搅拌、静置、过滤.在滤渣中加入足量盐酸后,发现沉淀减少但仍有少量不溶物.为进一步探究牙膏中摩擦剂的成分,同学们进行了以下探究:| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量牙膏样品,加水充分搅拌、过滤. | |
| 步骤2:取适量沉淀于试管中, |
|
| 步骤3: |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol苯分子中含有碳碳双键数为3NA |
| B、pH=13的氢氧化钠溶液中所含Na+为0.1NA |
| C、14g乙烯和丙烯的混合气体中所含原子总数为3NA |
| D、5.6g铁与足量的氯气反应失去电子数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com