
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| A | B | C | |||
| 1 | 35 | 2 | 4 | 1.6 | 5 |
| 2 | 60 | 1 | 2 | 0.4 | 3 |
| 3 | 60 | 1 | 2 | 0.4 | 1 |
| c(C)c(D) |
| c(A)c(B) |
| 1.6mol |
| 4mol |
| 0.4mol |
| 2mol |
| c(C)c(D) |
| c(A)c(B) |
| 0.4��0.4 |
| 0.6��1.6 |
| 1 |
| 6 |
| 1 |
| 6 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
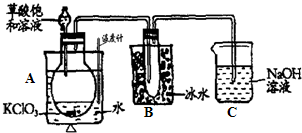
| A��װ������ž���ס |
| B��װ������ѡ�����¶Ƚϵ͵Ķ������У��Լ��ټ�ȩ�Ļӷ� |
| C��������ѡ����ɫ������װ�β��Ͻ���װ�� |
| D��ͨ����ȩ�����ͷ���ȫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
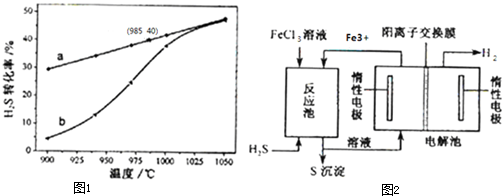
 ij��ѧʵ��С��Ϊȷ����������ֽ����Ѵ�����������ͼװ�ý���ʵ�飬��Ӧ�������ͷ�Ӧֹͣ��ʱ���������±���
ij��ѧʵ��С��Ϊȷ����������ֽ����Ѵ�����������ͼװ�ý���ʵ�飬��Ӧ�������ͷ�Ӧֹͣ��ʱ���������±���| MnO2 ʱ�� H2O2 | 0.1 g | 0.3 g | 0.8 g |
| 10 mL 1.5% | 223 s | 67 s | 56 s |
| 10 mL 3.0% | 308 s | 109 s | 98 s |
| 10 mL 4.5% | 395 s | 149 s | 116 s |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A����Ӧʱ�� |
| B���¶� |
| C��ѹǿ |
| D��N2��Ũ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
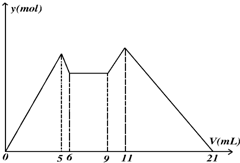 ��ͼ��ʾ������MgCl2��AlCl3�����Һ�У���ʼ�μ�6ml�Լ�A��6ml������μ�A���ɣ�֮��ĵ��Լ�B������ ����ymol ���Լ����V��ml����Ĺ�ϵ�����½��۴�����ǣ�������
��ͼ��ʾ������MgCl2��AlCl3�����Һ�У���ʼ�μ�6ml�Լ�A��6ml������μ�A���ɣ�֮��ĵ��Լ�B������ ����ymol ���Լ����V��ml����Ĺ�ϵ�����½��۴�����ǣ�������| A����6��9����Ӧ���ӷ�ӦʽH++OH-=H2O |
| B��ԭ���Һ�У�c��Al3+����c��Mg2+����c��Cl-��=1��1��5 |
| C��A������NaOH��B���������ᣬ��c��NaOH����c��HCl��=1��2 |
| D����A��B��ΪһԪǿ�����һԪǿ���V��A����V��B��=7��13 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com