
A.BaSO3和BaSO4 B.BaS?
C.BaSO3 D.BaSO4?
科目:高中化学 来源: 题型:阅读理解
 常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应.
常温下,在没有氧气存在时,铁粉与水几乎不反应,但在高温下,铁粉能与水蒸气反应.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
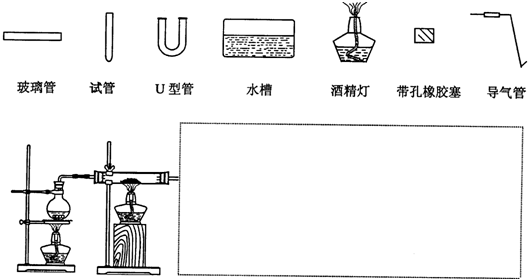
查看答案和解析>>
科目:高中化学 来源:2011届江苏省泰州中学高三上学期期中考试化学试题 题型:填空题
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是 (填序号)。
| A.硫酸铜 | B.二氧化氯 | C.臭氧 | D.硫酸亚铁 |
 H)3+4KOH
H)3+4KOH 下表列出了某厂排放
下表列出了某厂排放 的含锌废水中的含量及国家环保标准值的有关数据:
的含锌废水中的含量及国家环保标准值的有关数据:| | 某厂含锌废水水质 | 国家环保标准值 |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
 (填“符合”或“不符合”)国家环保标准。(常温下,Ksp[Zn(OH)2]=1.2×10-17)
(填“符合”或“不符合”)国家环保标准。(常温下,Ksp[Zn(OH)2]=1.2×10-17)查看答案和解析>>
科目:高中化学 来源:模拟题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:江苏模拟题 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com