
| A、pH=10的NaOH和Na2CO3溶液中,水的电离程度 |
| B、物质的量浓度相等的NH4NO3溶液和氨水中NH4+的物质的量浓度 |
| C、将pH=3的盐酸和醋酸分别加水稀释成pH=5的溶液,所加水的量 |
| D、相同温度下,10mL 0.1mol?L-1的醋酸和100mL 0.01mol?L-1的醋酸中H+物质的量 |
| 1×10-14 |
| 1×10-10 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
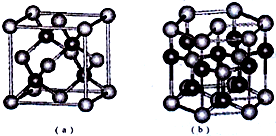 已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满.请根据以上信息,回答下列问题:
已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、将该溶液加水稀释,
| ||
| B、加入少量KOH固体,钠离子和碳酸根离子浓度均增大 | ||
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | ||
| D、c(Na+)=c(HCO3- )+2c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 可经三步反应制取
可经三步反应制取  ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在很多反应中IBr是强氧化剂 |
| B、IBr与水反应时既做氧化剂,又做还原剂 |
| C、IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D、IBr与NaOH溶液反应时,生成NaBr和NaIO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com