

| A. | 1 mol莽草酸完全燃烧消耗156.8 L O2 | |
| B. | 1 mol莽草酸最多与4 mol Na发生反应 | |
| C. | 莽草酸能使溴的四氯化碳溶液褪色 | |
| D. | 莽草酸可发生聚合反应 |
分析 有机物含有碳碳双键,可发生加成、加聚和氧化反应,含有羟基,可发生取代、消去和氧化反应,含有羧基,具有酸性,可发生中和、酯化反应,结合有机物的分子式解答该题.
解答 解:A.由结构简式可知该有机物的分子式为C7H10O5,可消耗氧气(7+$\frac{10}{4}$-$\frac{5}{2}$)mol=7mol,如在标准状况下,体积为156.8L,由于气体存在的体积不确定,则体积不确定,故A错误;
B.分子中含有3个羟基和1个羧基,都可与钠反应,则1mol莽草酸最多与4mol Na发生反应,故B正确;
C.分子中含有碳碳双键,可发生加成反应,能使溴的四氯化碳溶液褪色,故C正确;
D.含有碳碳双键,可发生加聚反应,故D正确.
故选A.
点评 本题考查有机物的结构和性质,该题是中等难度的试题,试题基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养.该题的关键是准确判断出分子中含有的官能团,然后结合具体官能团的结构和性质灵活运用即可,有利于培养学生的知识迁移能力和逻辑推理能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 矿泉水中不含任何化学物质 | |
| B. | 聚乙烯塑料薄膜可用作食品包装袋 | |
| C. | 碳酸钡可用作医疗上的“钡餐” | |
| D. | 氢氧化钠可用作治疗胃酸过多的药物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Na+O2═2Na2O | B. | NH4HCO3═NH3↑+H2O+CO2↑ | ||
| C. | NH3+HCl═NH4C1 | D. | H2SO4+2NaOH═Na2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
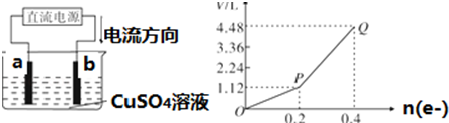
 如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种验证某气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C处红色布条颜色无变化;当关闭B,继续通入Cl2时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )| A. | 浓H2SO4 | B. | 饱和NaCl溶液 | C. | NaOH溶液 | D. | Ca (OH) 2悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
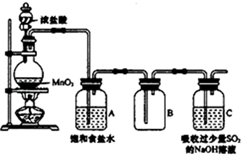 某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:
某科研小组用MnO2的浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对尾气进行吸收处理,如图所示:| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4溶液至溶液呈酸性,然后将所得溶液分别置于A、B试管中 | / |
| 步骤2:向A试管中滴加1-2滴0.01mol/LKMnO4溶液 | Ⅰ:若溶液紫红色褪去,则假设1成立; Ⅱ:若溶液紫红色不褪去,则假设2或3成立, |
| 步骤3:向B试管中滴加1-2滴淀粉KI溶液 | Ⅰ:若溶液变蓝色,则假设1成立; Ⅱ:若溶液不变蓝色,结合步骤2中的II,假设3成立, |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C (s)+O2(g)=CO (g)△H=-110.5 kJ/mol | |
| B. | C (s)+O 2(g)=CO2(g)△H=-393.5 kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O (l)△H=-571.6 kJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)=H2O (g)△H=-241.8 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com