
| A、维生素C具有还原性,在人体内起抗氧化作用 |
| B、新型氢动力计程车可以降低PM2.5的排放,减少大气污染 |
| C、碘是人体必需微量元素,所以要多吃富含高碘酸的食物 |
| D、高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱溶液会“断路” |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小 |
| B、需要95 mL 0.1 mol?L-1NaCl溶液,可选用100 mL容量瓶来配制 |
| C、用100 mL的量筒量取5.2 mL的盐酸 |
| D、用托盘天平称取25.20 g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2O含有的分子数为1 NA |
| B、100mL0.1mol/L Na2CO3溶液中含有的Na+离子数为0.1NA |
| C、通常状况下,NA个CO2分子占有的体积为22.4 L |
| D、48gO2和O3的混合气体中氧原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C6H12N4 |
| B、C4H8N4 |
| C、C6H10N4 |
| D、C6H8N4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
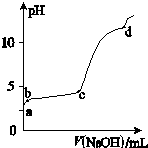 (Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.
(Ⅰ) 室温下,在30ml的 Al2(SO4)3溶液中,逐滴加入1.0mol?L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、I->Fe2+>Cl->SO2 |
| B、Cl->Fe2+>SO2>I- |
| C、Fe2+>I->Cl->SO2 |
| D、SO2>I->Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 1mol/L MgCl2溶液 |
| B、200mL 0.25mol/L AlCl3溶液 |
| C、200ml 1mol/L NaCl溶液 |
| D、200ml 0.5mol/L HCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com