
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
| 2.8L |
| 22.4L/mol |
| 5.6L |
| 22.4L/mol |
| 2.8L |
| 22.4L/mol |
| 5.6L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题,查看答案和解析>>
科目:高中化学 来源: 题型:
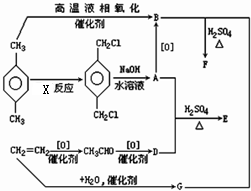 有机物E和F可用作塑料增塑剂或涂料中的溶剂,它们的分子量相等,可用以下方法合成:
有机物E和F可用作塑料增塑剂或涂料中的溶剂,它们的分子量相等,可用以下方法合成:查看答案和解析>>
科目:高中化学 来源: 题型:
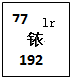 美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).
美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).| A、铱原子核外有77个电子 |
| B、铱元素的原子构成了一种非金属化合物 |
| C、铱原子核中有192个中子 |
| D、铱元素的相对原子质量为77 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Cl2光照 |
| ① |
| NaOH溶液 |
| ② |
| Cu、O2、加热 |
| ③ |
| 银氨溶液加热、酸化 |
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由2Cu+O2═2CuO可推出同族的硫也有Cu+S═CuS |
| B、Fe3O4可表示为FeO?Fe2O3,则Pb3O4可表示为PbO?Pb2O3 |
| C、Na能与水反应生成H2,K、Ca也能与水反应生成H2 |
| D、CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
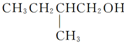 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
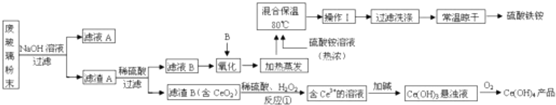
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它属于有机高分子 |
| B、它能产生“白色污染” |
| C、它形成的单体是乙烯 |
| D、对聚乙烯塑料垃圾应进行深埋或倾倒入海 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com