
| A. | c(Na+)+c(H+)=c(A-)+c(OH-) | B. | c(A-)>c(Na+)>c(H+)>c(OH-) | ||
| C. | 2c(Na+)=c(A-)+c(HA) | D. | c(Na+)>c(A-)>c(H+)>c(OH-) |
分析 HA为酸性略强于醋酸的一元弱酸,在等浓度的 NaA和HA的混合溶液中HA电离程度大于A-离子水解,溶液显酸性,
A.溶液中存在电荷守恒,溶液中阴阳离子所带电荷总数相同;
B.在等浓度的 NaA和HA的混合溶液中HA电离程度大于A-离子水解;
C.溶液中存在物料守恒分析;
D.在等浓度的 NaA和HA的混合溶液中HA电离程度大于A-离子水解.
解答 解:A.溶液中存在电荷守恒,c(Na+)+c(H+)=c(A-)+c(OH-),故A正确;
B.在等浓度的 NaA和HA的混合溶液中HA电离程度大于A-离子水解,溶液中离子浓度大小c(A-)>c(Na+)>c(H+)>c(OH-),故B正确;
C.在等浓度的 NaA和HA的混合溶液中存在物料守恒,2c(Na+)=c(A-)+c(HA),故C正确;
D.在等浓度的 NaA和HA的混合溶液中HA电离程度大于A-离子水解,溶液中离子浓度大小c(A-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选D.
点评 本题考查了离子浓度大小比较,根据电解质的性质确定溶液酸碱性,根据溶液酸碱性再结合电荷守恒、物料守恒来分析解答,离子浓度大小常常与盐类水解、弱电解质电离联合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 卤素是典型的非金属元素,其单质只具有氧化性而无还原性 | |
| B. | 卤素单质的熔点随相对分子质量的增大而升高 | |
| C. | 卤化银都不溶于水,也不溶于稍硝酸 | |
| D. | 卤化氢的水溶液都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c( NH4+)相等的NH4Cl溶液和(NH4)2Fe( SO4)2溶液中:c(Cl-)>c( SO42-) | |
| B. | 常温下,将pH=5的H2S04溶液加水稀释1000倍,所得溶液的pH=8 | |
| C. | 0.2 mol/LCH3COOH溶液与0.1 mol/LNaOH溶液等体积混合所得的溶液中:c( CH3COOH)+c( CH3COO -)=2c(Na+)=0.2 mol/L | |
| D. | 用甲基橙作指示剂,用标准盐酸滴定未知浓度的氨水,至终点时,溶液中:c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解度(s ) | B. | 物质的量浓度(c ) | C. | 质量分数(w%) | D. | 摩尔质量(M ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴乙烷不溶于水,能溶于大多数有机溶剂 | |
| B. | 溴乙烷与NaOH的醇溶液共热可生成乙醇 | |
| C. | 在溴乙烷中滴入AgNO3溶液,立即有淡黄色沉淀生成 | |
| D. | 溴乙烷通常用乙烷与液溴直接反应来制取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
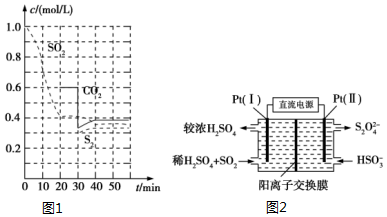 SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:
SO2直接排放会对环境造成危害.SO2的尾气处理通常有以下几种方法:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t∕min | 2 | 4 | 7 | 9 |
| n(Y)∕mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前4min的平均反应速率υ(Z)=0.0125 mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,反应达到新平衡前υ(逆)>υ(正) | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2molZ,达平衡时X的体积分数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com