
【题目】NaN3是一种易溶于水(NaN3=Na++N3-)的白色固体,可用于有机合成和汽车安全气囊的产气药等。钠法(液氨法)制备NaN3的工艺流程如下:

(1)钠元素位于周期表第______周期______族。
(2)NaNH2中氮元素的化合价为_______;Na+的结构示意图为_____。
(3)NaOH的电子式为______。
(4)反应NH4NO3![]() N2O↑+2H2O↑中,每生成1molN2O转移电子数为_____个。
N2O↑+2H2O↑中,每生成1molN2O转移电子数为_____个。
(5)反应①的化学方程式为______。
(6)销毁NaN3可用NaClO溶液,该销毁反应的离子方程式为______(N3-被氧化为N2)。
【答案】三 ⅠA -3 ![]()
![]() 2.408×1024 2NaNH2+N2O
2.408×1024 2NaNH2+N2O![]() NaN3+NH3+NaOH ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
NaN3+NH3+NaOH ClO-+2N3-+H2O=Cl-+2OH-+3N2↑
【解析】
(1)钠为11号元素,位于周期表第三周期ⅠA族;
(2)NaNH2中钠为+1价,氢为+1价,根据化合物各元素化合价代数和为0可知,氮元素的化合价为-3价;Na+的结构示意图为![]() ;
;
(3)NaOH为离子化合物,由钠离子与氢氧根离子构成,氢氧根离子中存在氢原子和氧原子之间的共价键,NaOH的电子式为![]() ;
;
(4)反应NH4NO3![]() N2O↑+2H2O↑中,氮元素由-3价升为+1价,由+5价降为+1价,故每生成1mol N2O转移电子数为2.408×1024个;
N2O↑+2H2O↑中,氮元素由-3价升为+1价,由+5价降为+1价,故每生成1mol N2O转移电子数为2.408×1024个;
(5)反应①为210-220℃下NaNH2与N2O反应生成NaN3和氨气,根据氧化还原反应方程式的配平及质量守恒可得反应的化学方程式为2NaNH2+N2O![]() NaN3+NH3+NaOH;
NaN3+NH3+NaOH;
(6)销毁NaN3可用NaClO溶液,将其氧化生成氮气,故该销毁反应的离子方程式为ClO-+2N3-+H2O=Cl-+2OH-+3N2↑。


科目:高中化学 来源: 题型:
【题目】25℃,几种物质的pH和浓度如下表所示.回答下列问题:

(1)c1___(填“>“'<C”或“=“)c2.
(2)溶液中水的电离程度②___(填“>“'<”或“=“)③.
(3)分别加水稀释10倍,稀释后四种溶液的pH由大到小的顺序为___(填序号).
(4)①溶液与④溶液等体积混合,溶液的pH___(填“>“'<“或“=”,下同)7;用④溶液滴定①荣而言,滴定过程中不可能出现的结果是___
A.c(NH4+)>c(Cl-)>c(OH-)>c(H+) B.c(NH4+)=c(Cl-)>c(OH-)=c(H+)
C.c(Cl-)>c(NH4+)>c(OH-)>c(H+) D.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
E.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PSCl3 、S2Cl2、SOCl2等含硫化合物用途非常广泛。
(1)PSCl3(结构式为: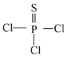 )中磷的化合价为______。
)中磷的化合价为______。
(2)S2Cl2分子中各原子均满足8电子结构,画出S2Cl2的结构式:_____。
(3)能说明同周期的相邻元素S的非金属性比Cl弱的事实是_____(填标号)。
A.H2SO3的酸性比HClO3的弱
B.气态H2S的热稳定性比HCl的弱
C.Cl2通入Na2S溶液可发生反应:Cl2+S2-=2Cl-+S↓
D.SO2是常见的还原剂,ClO2是常见的氧化剂
(4)SOCl2(沸点78.8℃)可用作锂电池的非水电解质及有机合成的氯化剂等。
①SOCl2可由S2Cl2、SO2及Cl2在催化剂和180~200℃时,通过发生化合反应制得,该反应的化学方程式为_____。
②Li/SOCl2电池的电池反应为:4Li+2SOCl2→4LiCl↓+S+SO2。电池工作时,下列说法正确的是____(填标号)。
A.Li电极的质量不变 B.电能转变为化学能
C.负极发生氧化反应 D.正极上SOCl2被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
2Z2(g),若X2、Y2、Z2的初始浓度分别为0.1 molL-1、0.3 molL-1、0.2 molL-1,当反应达到平衡后,各物质的浓度有可能的是( )
①X2为0.2 molL-1 ②Y2为0.1 molL-1 ③Z2为0.3 molL-1 ④Y2为0.6 molL-1
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 次氯酸的结构式:H—Cl—O B. 乙醇的结构简式: C2H6O
C. 硫离子的结构示意图:![]() D. 丙烷分子的球棍模型:
D. 丙烷分子的球棍模型:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合图像的是 ( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g)ΔH>0
2SO2(g)+O2(g)ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)ΔH<0
4NO(g)+6H2O(g)ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pCu=-1gc(Cu+),pX=-lgc(X-)。298K时,Ksp(CuCl)=a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是

A. 298K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B. 图中x代表CuI曲线,且P点c(Cu+)=c(I-)
C. 298K时增大M点的阴离子浓度,则y上的点向N点移动
D. 298K时CuBr(s)+I-(aq) ![]() CuI(s)+Br-(aq)的平衡常数K的数量级为103或102
CuI(s)+Br-(aq)的平衡常数K的数量级为103或102
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com