
分析 (1)由:(I)CO(g)+2H2(g)═CH3OH(g)△H=-90.1kJ•mol-1
(Ⅱ)2CO(g)+O2(g)═2CO2(g)△H=-556.0kJ•mol-1
(Ⅲ)2H2(g)+O2(g)═2H2O(l)△H=-572.0kJ•mol-1
根据盖斯定律,(Ⅱ)×$\frac{1}{2}$+(Ⅲ)-(I)可得:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);
(2)一氯甲烷(CH3Cl)在氢氧化钠水溶液、加热条件下发生水解反应生成甲醇与氯化钠.
解答 解:(1)由:(I)CO(g)+2H2(g)═CH3OH(g)△H=-90.1kJ•mol-1
(Ⅱ)2CO(g)+O2(g)═2CO2(g)△H=-556.0kJ•mol-1
(Ⅲ)2H2(g)+O2(g)═2H2O(l)△H=-572.0kJ•mol-1
根据盖斯定律,(Ⅱ)×$\frac{1}{2}$+(Ⅲ)-(I)可得:CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l),
则△H=$\frac{1}{2}$×(-556.0kJ•mol-1)-572.0kJ•mol-1-(-90.1kJ•mol-1)=-759.9kJ/mol,
故甲醇的燃烧热为759.9kJ/mol,
故答案为:759.9;
(2)一氯甲烷(CH3Cl)在氢氧化钠水溶液、加热条件下发生水解反应生成甲醇与氯化钠,反应方程式为:CH3Cl+NaOH$→_{△}^{水}$CH3OH+NaCl,
故答案为:CH3Cl+NaOH$→_{△}^{水}$CH3OH+NaCl.
点评 本题考查利用盖斯定律进行反应热计算、燃烧热含义、有机反应方程式书写等,关键是根据已知热化学方程式构造目标热化学方程式.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:解答题
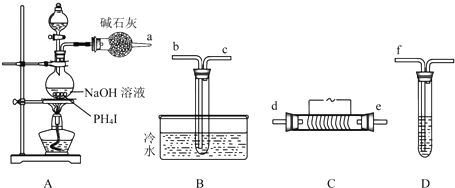
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
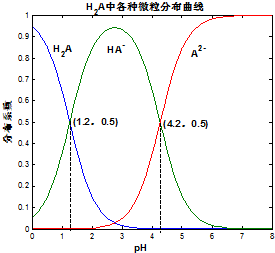 常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下 0.1mol/L的H2A溶液中H2A、HA-、A2- 三者中所占物质的量分数(分布系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在 0.1mol/L NaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的 Ka=10-3.45,将少量H2A的溶液加入足量NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
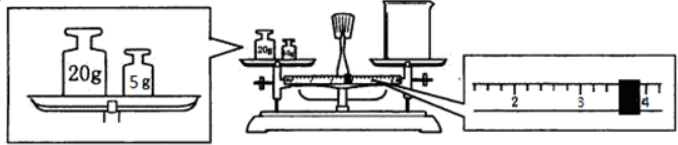
| A. | 称量12.5g固体NaOH时,将砝码放在左盘上,NaOH放在右盘上 | |
| B. | 选用的容量瓶中有少量蒸馏水 | |
| C. | 定容时俯视刻度线 | |
| D. | 定容摇匀后,液面下降,又加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
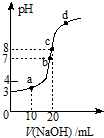 常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )
常温时,用0.10mol/L的NaOH溶液滴定20.00mL 0.10mol/L某 一元酸HA溶液所得滴定曲线如图.下列说法不正确的是( )| A. | a、b、c三点所示溶液导电能力最强的是c点对应的溶液 | |
| B. | 在c点溶液中:c(H+)+c(HA)=c(OH-) | |
| C. | 25℃,HA的电离平衡常数约为1.0×10-5 | |
| D. | a、b、c、d四点所示溶液中水的电离程度最大的是b点对应的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com