
有Ba(OH)2、NaHSO4、NaHCO3三种溶液的物质的量浓度相同,且为另一种溶液的物质的量浓度的2倍;若先将NaHSO4和NaHCO3溶液各100 mL混合反应后,再加入Ba(OH)2溶液100 mL,充分反应后,将生成的白色沉淀滤出,测得滤液中含有一种NaOH溶质,其物质的量浓度为0.9 mol/L(不考虑溶液混合时引起溶液体积的变化).试回答:
(1)通过分析,判断Ba(OH)2、NaHSO4、NaHCO3三种溶液哪两种溶液的物质的量浓度不可能相同?
________,原因是________.
(2)Ba(OH)2、NaHSO4、NaHCO3三种溶液可能的物质量浓度分别为:___________.
科目:高中化学 来源: 题型:阅读理解
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式________。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是_______(填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
② 适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=-49.0 kJ/mol。
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,v(H2)=______;氢气的转化率=_______;能使平衡体系中n(CH3OH)增大的措施有______。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。
已知:
CH4 (g) + 2O2(g) CO2(g)+2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g) H2O(l) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是_________[填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.
①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.c(CO32-)=c(HCO3-)+c(H2CO3)
②纯碱溶液呈碱性,其原因是(用离子方程式表示) ,
验证纯碱溶液呈碱性的实验方法(简述操作过程): 。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示) 。
④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。
查看答案和解析>>
科目:高中化学 来源:2013届辽宁省东北育才学校高三第一次模拟考试化学试卷(带解析) 题型:填空题
元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式) 。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程 。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式 。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式 。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为 ;若B为常见家用消毒剂的主要成分,则B的化学式是 。
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是 ;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2012学年山东省潍坊市高二寒假作业化学试卷(五) 题型:填空题
(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0 .30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n?c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
| A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D.c(CO32-)=c(HCO3-)+c(H2CO3) |
 。
。查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省汕头市高考模拟考试(一)理综化学试卷(解析版) 题型:计算题
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。写出②中反应的化学方程式__________________________。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入 2
mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
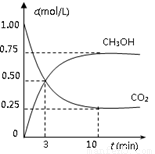
从反应开始到平衡,v(H2)= ;氢气的转化率= ;能使平衡体系中n(CH3OH)增大的措施有__________________________________________________。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) +2O2(g)=CO2(g)+2H2O(l) △H1=―890.3 kJ/mol
H2(g) + 1/2O2(g)=H2O(l) △H2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是____________________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
|
溶解度(S)/g |
溶度积(Ksp) |
||
|
Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
|
0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com