
【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
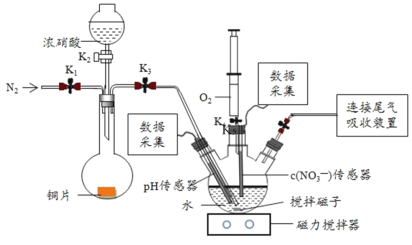
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入 一段时间N2,关闭K1 | _________ |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3―传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,_________;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量氧气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
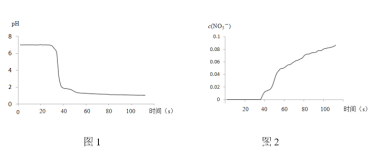
(解释及结论)
(1)NO2与水反应的离子方程式为____________ 。
(2)步骤I中,通入N2的目的是____________。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:____________。
(4)该实验验证NO2与水反应产物的实验证据包括____________(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.![]() 传感器记录所得数据
传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果____________
【答案】3NO2+H2O=2H++2NO3-+NO 除去空气中氧气,防止生成的NO被氧化 液面上方充满红棕色气体 BCD NO2中混有挥发的HNO3
【解析】
先向装置内通入氮气,除去空气中氧气,再利用浓硝酸和Cu作用制取NO2气体,并通入三颈烧瓶中与水反应,通过pH传感器和NO3-传感器检验有硝酸生成,利用针筒内氧气检验NO气体的生成。
(1)NO2与水反应生成硝酸和NO,反应的离子方程式为3NO2+H2O=2H++2NO3-+NO;
(2)步骤I中,通入N2的目的是除去空气中氧气,防止生成的NO被氧化;
(3)由Cu+4HNO3=Cu(NO3)2+2NO2↑+4H2O可知步骤II中圆底烧瓶内的实验现象为圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,液面上方充满红棕色气体;
(4)A.NO2与水反应生成硝酸和NO,与圆底烧瓶中溶液变为蓝绿色无关,故A错误;
B.三颈瓶内的气体从无色变为浅红棕色,说明NO和O2反应生成NO2,故B正确;
C.pH传感器记录所得数据显示反应后溶液显酸性,说明有酸生成,故C正确;
D.NO3-传感器记录所得数据显示反应后溶液中有NO3-生成,结合溶液显酸性,说明反应生成HNO3,故D正确;
故答案为BCD。
(5)浓硝酸有挥发性,未除去NO2中混有的HNO3,则无法根据传感器所记录的数据判断NO2溶于水生成硝酸,这是该实验不严谨的地方。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率,请回答下列问题。
(1)①工业合成氨反应:N2+3H2![]() 2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
2NH3是放热的可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知1molN2完全反应生成NH3可放出92kJ热量。如果将10molN2和足量H2混合,使其充分反应,放出的热量___(填“大于”、“小于”或“等于”)920kJ。
②已知断开1molN![]() N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2
N键吸收的能量为945.6kJ,形成1molN﹣H键放出的能量为391kJ,根据化学方程式N2+3H2![]() 2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
2NH3,生成标准状况下44.8LNH3时放出的能量为92.4kJ,则断开1molH﹣H键吸收的能量是___。
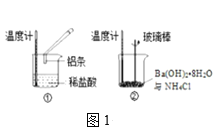
(2)某实验小组同学进行如图1所示实验,以检验化学反应中的能量变化。请根据你掌握的反应原理判断,②中的温度___(填“升高”或“降低”)。反应过程___(填“①”或“②”)的能量变化可用图2表示。
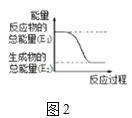
(3)已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图2所示,该反应是___(填“吸热”或“放热”)反应。
(4)用CH3OH和O2组合形成的质子交换膜燃料电池的结构如图3所示:

①则d电极是___(填“正极”或“负极”),c电极的电极反应式为___。
②若线路中转移2mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和钛金属的性能都很优越,在航空航天领域用途广泛。回答下列问题:
(1)钛元素基态原子的电子排布式为______________,未成对电子数为_______________个。
(2)[TiO(H2O2)2]2+配离子呈黄色。提供中心原子孤电子对的成键原子是_____________(填元素符号),中心原子的化合价为_____________;配体之一H2O2中氧原子杂化类型为__________,H2O2分子中氧原子的价层电子对互斥模型是______________。
(3)单质钒及钛都是由______________键形成的晶体,己知金属钛是六方最密堆积,金属钒是体心立方堆积,则__________(填“钛”,或“钒”)的空间利用率较大。
(4)碳化钒主要用于制造钒钢及碳化物硬质合金添加剂,其晶胞结构如图所示。
 (小球为V原子)
(小球为V原子)
①晶胞中碳原子与钒原子的数量比为____________。
②该晶胞中与碳原子距离最近且相等的碳原子个数为_____________。
③若合金的密度为dg· cm-3,晶胞参数α=______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别用υ(A)、υ(B)、υ(C)(molL﹣1s﹣1)表示,且υ(A)、υ(B)、υ(C)之间有如下所示的关系:υ(B)=3υ(A); 3υ(C)=2υ(B)。则此反应可表示为( )
A. 2A+3B![]() 2CB. A+3B
2CB. A+3B![]() 2C
2C
C. 3A+B![]() 2CD. A+B
2CD. A+B![]() C
C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在固定容积的密闭容器中,能表示反应X(g)+2Y(g)![]() 2Z(g)一定达到化学平衡状态的是
2Z(g)一定达到化学平衡状态的是
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中气体的压强不再发生变化
④单位时间内生成n mol Z,同时生成n mol X
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁粉具有平肝镇心,消痈解毒之功效,主治惊痫、癫狂、脚气冲心、贫血等。某兴趣小组探究用氢气和碳酸亚铁制取铁粉并检验反应产物,实验装置如图。下列说法不正确的是
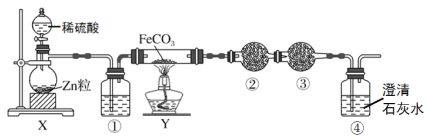
A.通过调节分液漏斗的活塞以控制①中气泡产生快慢
B.装置①的作用是干燥氢气
C.装置②、③中的药品分别是无水硫酸铜、碱石灰
D.加热装置Y前,应先让X反应一段时间,排除装置中的空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3X(g)+Y(g)![]() Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________; (2)增大压强:____________;
(3)增大容器容积:____________; (4)加入X:______________;
(5)加入Y:______________; (6)压缩体积:______________;
(7)加入催化剂_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
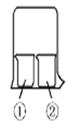
①中的物质 | ②中的物质 | 预测①中现象 | |
A | 淀粉碘化钾溶液 | 浓硝酸 | 无明显现象 |
B | 酚酞溶液 | 浓盐酸 | 无明显现象 |
C | 氯化铝溶液 | 浓氨水 | 有白色沉淀 |
D | 湿润红纸条 | 饱和氯水 | 红纸条褪色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH= - 393.5 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(l) ΔH= - 285.8 kJ·mol-1
O2(g)===H2O(l) ΔH= - 285.8 kJ·mol-1
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH= - 870.3 kJ·mol-1
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为_____________
(2)已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧的热化学方程式是______________。
(3)在25 ℃、101 kPa时,1.00 g C6H6(l)燃烧生成CO2(g)和H2O(l),放出41.8 kJ的热量,C6H6的燃烧热ΔH=________kJ·mol,该反应的热化学方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com