
| A. | 100℃时,pH=6的纯水中,c(OH-)与c(H+)之比 | |
| B. | 常温下,pH=1的HF溶液与0.1mol•L-1的盐酸中c(H+)之比 | |
| C. | 常温下,pH=7的CH3COOH与CH3COONa的混合溶液中,c(CH3COO-)与c(Na+)之比 | |
| D. | 常温下,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中溶质的物质的量浓度之比 |
分析 A、在纯水中氢离子的浓度与氢氧根离子的浓度相等;
B、pH=1的HF溶液氢离子的浓度为0.1mol•L-1;
C、根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),结合PH=7分析解答;
D、c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$结合化学式中氢氧根离子和化学式的关系分析.
解答 解:A、在纯水中氢离子的浓度与氢氧根离子的浓度相等,所以c(OH-)与c(H+)之比为1:1,故A正确;
B、pH=1的HF溶液氢离子的浓度为0.1mol•L-1,而盐酸是一元强酸酸的浓度等于氢离子的浓度,所以两者氢离子的浓度相等,故B正确;
C、根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),PH=7说明溶液中c(OH-)=c(H+),所以c(CH3COO-)=c(Na+),故C正确;
D、根据c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$知,pH=12的Ba(OH)2溶液与pH=12的KOH溶液中氢氧根离子浓度相等为0.01mol/L,但溶质的物质的量浓度之比=0.005mol/L:0.01mol/L=1:2,故D错误;
故选D.
点评 本题考查了pH的有关计算,明确弱电解质的电离特点是解本题关键,学生要清楚纯水中,氢离子的浓度等于氢氧根离子的浓度,为易错点.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题
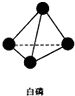 ,并指出1mol白磷(P4)含有P-P键的数目6NA
,并指出1mol白磷(P4)含有P-P键的数目6NA查看答案和解析>>
科目:高中化学 来源: 题型:选择题
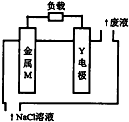 锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中.某金属燃料电池的基本结构如图所示,其中Y电极为石墨.下列说法正确的是( )
锌、铁、镁、铝、锂等金属都可以用在金属燃料电池中.某金属燃料电池的基本结构如图所示,其中Y电极为石墨.下列说法正确的是( )| A. | 该电池工作时,电子沿M→电解液→Y电极流动 | |
| B. | 若M为铝,则该电池工作时溶液的pH将不断增大 | |
| C. | 若M为镁,则该电池反应的化学方程式为2Mg+O2=2MgO | |
| D. | 若M为铁,则该电池工作时负极发生的反应为Fe-2e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中:Na+、K+、Cl-、CO32- | |
| B. | 淀粉溶液中:K+、NH4+、SO42-、I- | |
| C. | Na2SiO3溶液中:Cl-、I-、K+、CO2 | |
| D. | 葡萄糖溶液中:Na+、H+、SO42-、Cr2O72- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1 | |
| B. | 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液的c(NH4+):①>③>② | |
| C. | 浓度相同的氨水与盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 将amol•L-1CH3COOH与bmol•L-1NaOH溶液等体积混合,测得溶液pH为7,则a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镶嵌冰密度不可能比4℃水大 | |
| B. | 镶嵌冰中四角形环比八角形环中水分间的氢键键能强 | |
| C. | 每个水分子形成两个氢键 | |
| D. | 镶嵌冰属于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| W | X | Y | |
| T | Z | ||
| M |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质TY2、WZ4在通常情况下状态相同 | |
| D. | M元素的单质具有半导体的特性,M与Z元素可形成化合物MZ4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com