
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由苯硝化制硝基苯;由乙醇氧化制乙醛 | |
| C. | 由乙酸和乙醇制乙酸乙酯;由乙酸乙酯水解制乙醇 | |
| D. | 由氯代乙烷制乙烯;由丙烯制1,2-二溴丙烷 |
分析 A.由溴丙烷水解制丙醇,为取代反应;由丙烯与水反应制丙醇,为加成反应;
B.由苯硝化制硝基苯为取代反应;由乙醇氧化制乙醛为氧化反应;
C.酯化反应、水解反应均为取代反应;
D.由氯代乙烷制乙烯为消去反应;由丙烯制1,2-二溴丙烷为加成反应.
解答 解:A.由溴丙烷水解制丙醇,为取代反应;由丙烯与水反应制丙醇,为加成反应,反应类型不同,故A不选;
B.由苯硝化制硝基苯为取代反应;由乙醇氧化制乙醛为氧化反应,反应类型不同,故B不选;
C.酯化反应、水解反应均为取代反应,反应类型相同,故C选;
D.由氯代乙烷制乙烯为消去反应;由丙烯制1,2-二溴丙烷为加成反应,反应类型不同,故D不选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L乙醛完全燃烧后,生成CO2的分子数为2NA | |
| B. | 1L 0.1mol/L乙酸溶液中所含乙酸分子数为0.1NA | |
| C. | 常温常压下,14g乙烯、丙烯、丁烯的混合气体所含原子总数为3NA | |
| D. | 1mol甲基所含电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
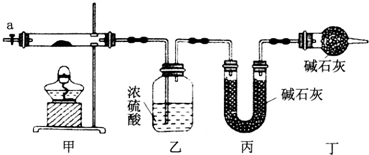
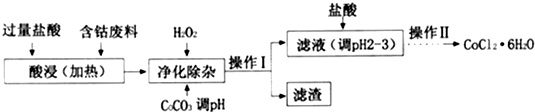
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件.断肠 草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式.下列有关说法正确的是( )
近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件.断肠 草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式.下列有关说法正确的是( )| A. | ②中所含官能团种类比③中多 | |
| B. | ①、④互为同系物 | |
| C. | ①、②、③、④均由C、H、O三种元素组成 | |
| D. | 等物质的量的②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com