
【题目】某温度下,向25.00mL 0.1 mol·L-1NaOH溶液中滴加0.1 mol·L-1甲酸(HCOOH,弱酸)溶液,所得溶液的pH和pOH[pOH=-lg c(OH-)]的关系如图所示。下列说法正确的是( )

A.F点对应甲酸溶液体积V=25.00 mL
B.F点水的电离程度大于E点水的电离程度
C.温度不变,加水稀释E点溶液,c(HCOOH)/c(HCOO-)增大
D.G点对应溶液c(OH-)=102a-b mol·L-1
【答案】B
【解析】
A. F点pOH=pH,溶液呈中性,NaOH与HCOOH反应得到强碱弱酸盐,等浓度等体积反应后溶液不是中性;
B. F至E的过程中,甲酸属于过量,对水的抑制程度逐渐增大,水的电离程度逐渐减小,
C. E点溶液溶质为甲酸、甲酸钠,加水稀释过程中,溶液中c(H+)逐渐减小;
D. 由E点可知,该温度下KW=10-amol/L×10-amol/L=10-2a,G点c(H+)=10-bmol/L,根据 进行计算。
进行计算。
A、F点pOH=pH,溶液呈中性,因甲酸钠属于强碱弱酸盐,甲酸根离子水解呈碱性,故F点对应V>25.00mL,A项错误;
B、当加入甲酸溶液为25mL时,溶液中溶质为甲酸钠,此时pH>pOH,F至E的过程中,甲酸属于过量,对水的抑制程度逐渐增大,水的电离程度逐渐减小,即F点水的电离程度大于E点水的电离程度,B项正确;
C、E点溶液溶质为甲酸、甲酸钠,加水稀释过程中,溶液中c(H+)逐渐减小, ,温度不变,则Ka不变,该比值逐渐减小,C项错误;
,温度不变,则Ka不变,该比值逐渐减小,C项错误;
D、由E点可知,该温度下KW=10-amol/L×10-amol/L=10-2a,G点c(H+)=10-bmol/L,则 =10b-2amol/L,故D错误;
=10b-2amol/L,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下列实验结果不能作为相应定律或原理的证据之一的是( )
(阿伏加德罗定律:在同温同压下,相同体积的任何气体含有相同数目的分子)
A | B | C | D | |
勒夏特列原理 | 元素周期律 | 盖斯定律 | 阿伏伽德罗定律 | |
实验方案 |
|
|
|
|
结果 | 左球气体颜色加深 右球气体颜色变浅 | 烧瓶中冒气泡 试管中出现浑浊 | 测得 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 
B. 
C. 
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是有机化学中的几个重要实验。图一是制取乙酸乙酯,图二是验证醋酸、碳酸、苯酚酸性强弱;图三是实验室制取乙炔并检验其部分性质。请根据要求填空。
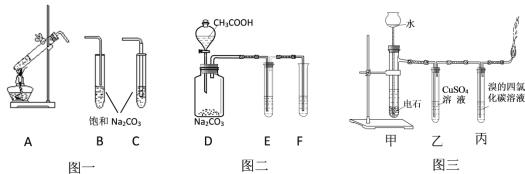
(1)图一中A发生的化学方程式为__________, A的导管应与_______相连(填字母)。
(2)图二中的E和F分别盛装的药品应为_____________和______________。
A.石蕊溶液 B.苯酚钠溶液 C.碳酸氢钠溶液 D.碳酸钠溶液
(3)图三中乙装置的作用是_______________,实验过程中发现燃烧非常剧烈,分析其主要原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如图所示,下列有关说法错误的是( )

A. 曲线 M 表示 pH与lg![]() 的变化关系
的变化关系
B. Ka2(H2Y)=10-4.3
C. d 点溶液中: c(H+)-c(OH -)=2c(Y2-)+ c(HY-)-c(K+)
D. 交点 e 的溶液中: c(H2Y) = c(Y2-) > c(HY-)> c(H+)> c(OH -)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家合成了一种新的化合物,其结构式如图所示。该物质中 W、X、Y、Z、M是短周期中常见元素,且原子序数依次增大;已知M元素原子核外电子总数是Y元素原子核外 电子总数的两倍。下列说法中错误的是
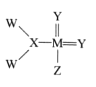
A.由X和Y两种元素形成的化合物有多种
B.W和Z元素位于周期表中同一主族
C.元素的非金属性强弱顺序为:Z>Y>X
D.Y、M元素的气态氢化物沸点高低为:Y>M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气溶于水形成的饱和溶液中,存在以下的溶解平衡和电离平衡:NH3+H2O![]() NH3H2O,NH3H2O
NH3H2O,NH3H2O![]() NH4++OH-,这些平衡都满足勒夏特列原理,若向已达到平衡的体系中通入下列物质,请填空。
NH4++OH-,这些平衡都满足勒夏特列原理,若向已达到平衡的体系中通入下列物质,请填空。
(1)加入少量氨气,平衡向___(填“正”或“逆”,下同)反应方向移动。
(2)通入HCl气体,平衡向___反应方向移动,c(NH4+)___(填“增大”或“减小”,下同)。
(3)加入NaOH固体,平衡向___反应方向移动,c(OH-)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】矿盐主要成分是NaCl,还含有![]() 等其他可溶性杂质离子。下列有关说法正确的是
等其他可溶性杂质离子。下列有关说法正确的是
A.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.由矿盐生成食盐,除去![]() 最合适的试剂是
最合适的试剂是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com